Cho hỗn hợp X chứa 2,4 gam Mg và 10,64 gam Fe vào dung dịch Y chứa 0,2 mol Cu(NO3)2 và 0,3 mol AgNO3. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Z và m gam kim loại. Giá trị của m là:
A. 45,20
B. 32,40
C. 43,04
D. 41,36
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
nMg = 0,1 ; nFe = 0,19 mol
Thứ tự phản ứng :
Mg + 2Ag+ -> Mg2+ + 2Ag
Fe + 2Ag+ -> Fe2+ + 2Ag
Fe + Cu2+ -> Fe + Cu
=> Kết tủa gồm : Ag : 0,3 mol ; Cu : 0,14 mol
=> m = 41,36g

Đáp án A
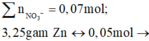 cuối cùng Y cho 0,035 mol
Z
n
(
N
O
3
)
2
cuối cùng Y cho 0,035 mol
Z
n
(
N
O
3
)
2
Bảo toàn khối lượng lần 1: mchất tan trong X
![]()
Bảo toàn khối lượng lần 2||

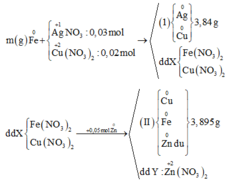
Từ sơ đồ phản ứng ta thấy Fe từ số oxi hóa 0 vẫn về 0
=> ne( Ag+, Cu2+ nhận) = ne ( Zn nhường)
Mà ∑ ne ( Ag+, Cu2+ nhận) = 0,03.1 + 0,02.2 = 0,07 < ne ( Zn nhường) = 0,1 (mol)
=> Zn còn dư sau phản ứng
=> nZn pư = ½ ne nhận = ½. 0,07 = 0,035 (mol)
=> nZn dư = 0,05 – 0,035 = 0,015 (mol)
mFe + mAg bđ + mCu bđ + mZn dư = mAg+Cu (I) + mCu + Fe + Zn (II)
=> mFe = mAg+Cu (I) + mCu + Fe + Zn (II) - ( mAg bđ + mCu bđ + mZn dư )
=> mFe = 3.84 + 3,895 – (0,03.108 + 0,02.64 + 0,015. 65)
mFe = 2,24 (g)
Đáp án B

Chọn đáp án B
Có 0,2.(0,15 + 0,1.2) = 0,07 mol nitrat trong suốt quá trình phản ứng, và như thế theo tiêu chí kim loại càng mạnh càng sót lại trước tiên thì dung dịch Y chỉ còn ion của kẽm khi lượng được đưa vào X lên tới 3,25/65 = 0,05 mol nên có 0,035 mol Zn2+ trong Y.
Bảo toàn khối lượng phần kim loại
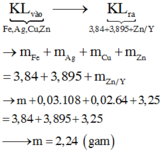
Đáp án D