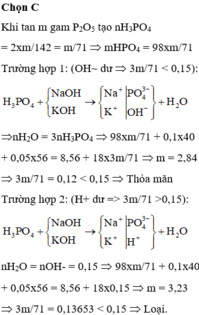
Cho x gam P2O5 vào dung dịch chứa 0,08 mol KOH; 0,02 mol NaOH; 0,02 K3PO4 và 0,04 mol Na3PO4. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 1918x/355 gam hỗn hợp muối. Giá trị của x là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

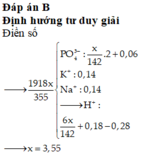

1)
$n_{P_2O_5} = 0,05(mol) \Rightarrow n_{H_3PO_4} = 0,05.2 = 0,1(mol)$
$n_{KOH} = 0,2(mol) = 2n_{H_3PO_4}$. Suy ra : muối là $K_2HPO_4$
$n_{K_2HPO_4} = n_{H_3PO_4} = 0,1(mol)$
$m_{muối} = 0,1.174 = 17,4(gam)$
2)
$n_{H_3PO_4} = 2n_{P_2O_5} = 0,2(mol)$
$1 < n_{KOH} : n_{H_3PO_4} = 0,35 : 0,2 = 1,75 < 2$ nên muối gồm $KH_2PO_4$ và $K_2HPO_4$

Đặt nP= x mol, nOH- =0,15 mol
TH1: Axit dư, x > 0,15
Dễ thấy chất rắn gồm
(x-0,15)/2 mol P2O5, 0,1 mol NaH2PO4, 0,05 mol KH2PO4
→mrắn= 142. (x-0,15)/2+ 99.0,1+ 136.0,05 > 8,56 gam (Vô lí)
TH2: Kiềm dư, x < 0,15/3= 0,05
Chất rắn gồm: x mol PO43-, 0,15-3x mol OH-, 0,1 mol Na+, 0,05 mol K+
→ mrắn= 95x+ 17. (0,15-3x)+ 23.0,1+ 39.0,05= 8,56 gam
→ x= 0,04
Vậy nP2O5= 0,02 mol→m= 2,84 gam
TH3: Tạo hỗn hợp muối, 0,05 < x< 0,15
Chất rắn gồm:
H2PO4-, HPO42-, PO43- (hai trong 3 gốc này): x mol; K+: 0,05 mol, Na+: 0,1 mol
→mrắn= M.x+ 23.0,1+ 39.0,05
Vì x> 0,05 và M> 95 nên mrắn > 95.0,05+ 2,3+1,95=9 >8,56
→Không thỏa mãn
Đáp án D

Đáp án D
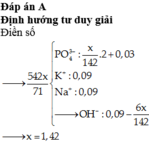
Giả sử kiềm có công thức chung là MOH (M=(0,1.23+0,05.39)/0,15=85/3)
Nếu phản ứng chỉ tạo 1 muối:
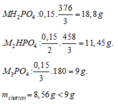
=> MOH dư, phản ứng tạo muối M3PO4.
Đặt nM3PO4=x mol, nMOH=y mol;
180x+136y/3=8,56
3x+y=nMOH=0,15
=> x=0,04, y=0,03.
=> nP2O5=0,04/2=0,02 mol
=> mP2O5=2,84 gam.

Đáp án B
Giả sử dung dịch kiềm có công thức chung là: MOH: 0,15 (mol) với
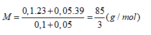
+ Nếu phản ứng chỉ tạo 1 muối:
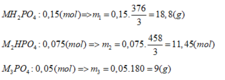
Ta thấy 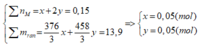
BTNT: P => nP = nMH2PO4 + nM2PO4 = 0,05 + 0,05 = 0,1 (mol)
=> nP2O5 = ½ nP = 0,05 (mol)
=> mP2O5 = 0,05. 142 = 7,1 (g)