Một thanh đồng nặng 140,8 gam sau khi đã ngâm trong dung dịch AgNO3 có khối lượng là 171,2 gam. Tính thể tích dung dịch AgNO3 32% (D= 1,2g/ml) đã tác dụng với thanh đồng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+Ag\\ Đặt:n_{Cu\left(pứ\right)}=x\left(mol\right)\\ Tacó:m_{tăng}=171,2-140,8=m_{Ag}-m_{Cu}=108.2x-64x\\ \Rightarrow x=0,2\left(mol\right)\\ \Rightarrow m_{ddAgNO_3}=\dfrac{0,2.2.170}{32\%}=212,5\left(g\right)\\ \Rightarrow V_{AgNO_3}=\dfrac{212,5}{1,2}=177,083\left(ml\right)\)
Khối lượng thanh đồng tăng là Δm = 171,2 – 140,8 = 30,4 (g)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
x 2.x(mol) 2x(mol)
Gọi x là số mol Cu phản ứng
Ta có Δm = mAg - mCu = 2. 108x - 64x = 152x
⇒ 152x = 30,4 ⇒ x = 0,2 (mol)
Khối lượng của AgNO3 là mAgNO3 = 0,2. 2. 170 = 68 (g)
Thể tích dung dịch AgNO3 là

Đáp án : C
, nCu2+ = 0,2 mol ; nAg+ = 0,1 mol
,mdung dịch giảm = mkim loại tăng = 2g

\(\Delta_m=2,28\left(g\right)=m_{Ag}-m_{Cu\text{ p/ứ}}\left(1\right)\\ PTHH:Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\\ \Rightarrow n_{Cu}=\dfrac{1}{2}n_{AgNO_3}\left(2\right)\\ \left(1\right)\left(2\right)\Rightarrow108n_{AgNO_3}-\dfrac{1}{2}n_{AgNO_3}\cdot64=2,28\left(g\right)\\ \Rightarrow n_{AgNO_3}=0,03\left(mol\right)\\ m_{dd_{AgNO_3}}=1,14\cdot60=68,4\left(g\right)\\ n_{Cu}=n_{CuNO_3}=0,015\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{CT_{CuNO_3}}=0,015\cdot188=2,82\left(g\right)\\m_{Cu}=0015\cdot64=0,96\left(g\right)\end{matrix}\right.\\ n_{Ag}=0,03\left(mol\right)\\ \Rightarrow m_{Ag}=0,03\cdot108=3,24\left(g\right)\)
\(\Rightarrow m_{dd_{CuNO_3}}=0,96+68,4-3,24=66,12\left(g\right)\\ \Rightarrow C\%_{CuNO_3}=\dfrac{2,82}{66,12}\cdot100\%\approx4,26\%\)
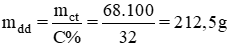
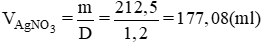

Khối lượng thanh đồng tăng là Δm = 171,2 – 140,8 = 30,4 (g)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
x 2.x(mol) 2x(mol)
Gọi x là số mol Cu phản ứng
Ta có Δm = mAg - mCu = 2. 108x - 64x = 152x
⇒ 152x = 30,4 ⇒ x = 0,2 (mol)
Khối lượng của AgNO3 là mAgNO3 = 0,2. 2. 170 = 68 (g)
Thể tích dung dịch AgNO3 là