Dẫn 1,12 lít khí lưu huỳnh đioxit (đktc) đi qua 700 ml dung dịch Ca OH 2 0,1M. Viết phương trình hoá học.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng các chất sau phản ứng :
Số mol các chất đã dùng :
n SO 2 = 1,12/22,4 = 0,05 mol; n Ca OH 2 = 0,1x700/1000 = 0,07 mol
Theo phương trình hoá học, lượng Ca OH 2 đã dùng dư. Do đó khối lượng các chất sau phản ứng được tính theo lượng SO 2
0,05 mol SO 2 tác dụng với 0,05 mol Ca OH 2 sinh ra 0,05 mol CaSO 3 và dư 0,07 - 0,05 = 0,02 (mol) Ca OH 2
Khối lượng các chất sau phản ứng là :
m CaSO 3 = 120 x 0,05 = 6 (gam)
m Ca OH 2 = 74 x 0,02 = 1,48 (gam)

Chọn C

S O 2 hết, Ca( O H ) 2 dư, phản ứng tạo muối CaS O 3
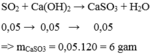

a, SO2 + Ca(OH)2--> CaSO3 + H2O
b, Ta có nSO2=1,12/22,4=0,05 mol
nCa(OH)2=0,1.0,7=0,07 mol
Ta có tỉ lệ : nSO2/1< nCa(OH)2/1
=> Ca(OH)2 dư , CO2 hết
=> nCa(OH)2 PỨ= nCaSO3=nSO2=0,05 mol=nH2O
=> mCa(OH)2 dư=(0,07-0,05).74=1,48 g
mCaSO3=0,05.120=6 g
mH2O=0,05.18=0,9 g
nSO2=1,12:22,4=0,05mol
nCa(OH) 2=0,1.0,7=0,07mol
SO2+Ca(OH)2--->CaSO3+H2O
0,05mol 0,07mol
0,05mol -->0,05mol -->0,05mol -->0,05mol
mCaSO3=0,05.120=6g
mH2O=0,05.18=0,9g

Số mol của lưu huỳnh đioxit ở dktc
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
700ml = 0,7l
Số mol của dung dịch canxi hidroxi CMCa(OH)2 = \(\dfrac{n}{V}\Rightarrow n=C_m.V=0,1.0,7=0,07\left(mol\right)\)
Pt : SO2 + Ca(OH)2 → CaSO3 + H2O\(|\)
1 1 1 1
0,05 0,07 0,05
a) Tên muối tạo thành là : canxi sunfit
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,07}{1}\)
⇒ SO2 phản ứng hết , Ca(OH)2 dư
⇒ Tính toán dựa vào số mol của SO2
Số mol của muối canxi sunfit
nCaSO3 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối canxi sunfit
mCaSO3 = nCaSO3 . MCaSO3
= 0,05 . 120
= 6 (g)
Số mol dư của dung dịch canxi hidroxit
ndư = nban đầu - nmol
= 0,07 - (0,05 . 1)
= 0,02 (mol)
Khối lượng dư của dung dịch canxi hidroxit
mdư = ndư . MCa(OH)2
= 0,02 . 74
= 1,48 (g)
Chúc bạn học tốt

a)
PTHH : \(SO_2+Ca\left(OH\right)_2\rightarrow CáO_4+H_2O\)
b)
Ta có :
\(n_{SO_2}=\frac{0,224}{22,4}=0,01\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,01\times1,4=0,014\)
Theo ptpư : \(n_{SO_2}=n_{Ca\left(OH\right)_2}=n_{CaSO_3}=n_{H_2O}\)
Vậy nCa(OH)2 ( dư ) = \(n_{Ca\left(OH\right)_2\left(bđ\right)}-n_{Ca\left(OH\right)_2\left(pư\right)}\)
\(=0,014-0,001=0,004\left(mol\right)\)
Phương trình hoá học :
SO 2 + Ca OH 2 → CaSO 3 + H 2 O