Đốt cháy hoàn toàn m gam chất hữu cơ A cần phải dùng 19,2 gam oxi, thu được 26,4 gam CO 2 và 10,8 gam H 2 O . Xác định công thức đơn giản nhất của A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


M A = 30n → 170 < 30n < 190
→ n = 6.
Công thức phân tử của A là C 6 H 12 O 6

a)
nCO2 = 26,4 : 44 = 0,6 mol => nC = 0,6 mol
nH2O = 10,8 : 18 = 0,6 mol => nH = 1,2 mol
nO = 13,44 : 22,4 = 0,6 mol
nC : nH : nO = 0,6 : 1,2 : 0,6 = 1:2:1
=> Công thức đơn giản : (CH2O)n
b) Có 170 < MA < 190
=> 170 < 30n < 190
=> 30n = 180 => n = 6
=> Công thức phân tử : C6H12O6
\(a)n_C = n_{CO_2} = \dfrac{26,4}{44} =0,6(mol)\\ n_{H_2O} = \dfrac{10,8}{18} = 0,6(mol) \Rightarrow n_H = 0,6.2 = 1,2(mol)\\ n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol) \Rightarrow n_O = 0,6.2 + 0,6 - 0,6.2 = 0,6(mol)\\ n_C : n_H : n_O = 0,6 : 1,2 : 0,6 = 1 : 2 : 1\\ CTĐGN : CH_2O\\ b) CTPT : (CH_2O)_n\\ \Rightarrow 170 < (12 + 2 + 16)n < 190 \\ \Leftrightarrow 5,6 < n < 6,3 \Rightarrow n = 6\\ CTPT : C_6H_{12}O_6\)

\(n_{CO_2}=\dfrac{26.4}{44}=0.6\left(mol\right)\)
\(n_{H_2O}=\dfrac{10.8}{18}=0.6\left(mol\right)\)
\(n_O=\dfrac{18-0.6\cdot12-0.6\cdot2}{16}=0.6\left(mol\right)\)
\(n_C:n_H:n_O=0.6:1.2:0.6=1:2:1\)
CT đơn giản nhất : \(CH_2O\)
\(M_X=45\cdot2=90\left(\dfrac{g}{mol}\right)\)
\(\Leftrightarrow30n=90\)
\(\Leftrightarrow n=3\)
\(CT:C_3H_6O_3\)

Câu 7:
\(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn C: nC = 0,6 (mol)
Bảo toàn H: nH = 1,2 (mol)
=> \(n_O=\dfrac{10,8-0,6.12-1,2}{16}=0,15\left(mol\right)\)
=> nC : nH : nO = 0,6 : 1,2 : 0,15 = 4:8:1
=> CTPT: (C4H8O)n
Mà M = 2,25.32 = 72(g/mol)
=> n = 1
=> CTPT: C4H8O
Câu 6
\(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn C: nC = 0,25 (mol)
Bảo toàn H: nH = 0,6 (mol)
=> \(n_O=\dfrac{4,4-0,25.12-0,6.1}{16}=0,05\left(mol\right)\)
nC : nH : nO = 0,25 : 0,6 : 0,05 = 5:12:1
=> CTPT: (C5H12O)n
Mà M = 44.2=88(g/mol)
=> n = 1
=> CTPT: C5H12O
Câu 8:
MX = 1,875.32 = 60 (g/mol)
Giả sử có 1 mol chất X => mX = 60.1 = 60 (g)
\(m_C=\dfrac{60.40}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{60.6,67}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(m_O=60-24-4=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> Trong 1 mol X chứa 2 mol C, 4 mol H, 2 mol O
=> CTPT: C2H4O2

$n_C = n_{CO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
$n_H = 2n_{H_2O} = 2.\dfrac{1,8}{18} = 0,2(mol)$
$n_O = \dfrac{1,8 - 0,08.12 - 0,2.1}{16} = 0,04(mol)$
Ta có :
$n_C : n_H : n_O = 0,08 : 0,2 : 0,04 = 2 : 5 : 1$
Vậy CTĐGN là $C_2H_5O$
CTPT : $(C_2H_5O)_n$
$M_A = (12.2 + 5 + 16)n = 45.2 \Rightarrow n = 2$
Vậy CTPT là $C_4H_{10}O_2$
\(n_{CO_2}=\dfrac{1.792}{22.4}=0.08\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(n_O=\dfrac{1.8-0.08\cdot12-0.1\cdot2}{16}=0.04\left(mol\right)\)
\(n_C:n_H:n_O=0.08:0.2:0.04=2:5:1\)
Công thức đơn giản nhất : C2H5O
\(M_A=2\cdot45=90\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow45n=90\)
\(\Rightarrow n=2\)
\(CT:C_4H_{10}O_2\)

\(n_{CO_2}=\dfrac{17.92}{22.4}=0.8\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(n_O=\dfrac{24.4-0.8\cdot12-1\cdot2}{16}=0.8\left(mol\right)\)
\(n_C:n_H:n_O=0.8:2:0.8=4:10:4\)
CT đơn giản nhất : C4H10O4
\(M_A=61\cdot2=122\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow122n=122\)
\(\Rightarrow n=1\)
\(CT:C_4H_{10}O_4\)
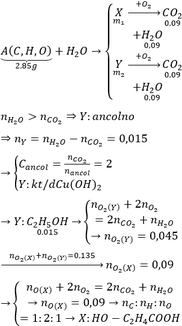
Sơ đồ phản ứng cháy của A :
A + O 2 → t ° CO 2 + H 2 O
Ta có: m A + m O 2 = m CO 2 + m H 2 O
→ m A = m CO 2 + m H 2 O - m O 2 = 26,4 + 10,8 - 19,2 = 18g
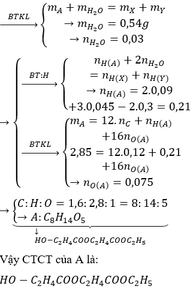
Khối lượng C trong 18 gam A là : 26,4/44 x 12 = 7,2g
Khối lượng H trong 18 gam A là : 10,8/18 x 2 = 1,2g
Khối lượng O trong 18 gam A lấ 18 - 7,2 - 1,2 = 9,6 (gam).
Gọi công thức hoá học của A là C x H y O z
Ta có quan hệ
12x : y : 16z = 7,2 : 1,2 : 9,6
x : y : z = 7,2/12 : 1,2/1 : 9,6/16 = 0,6 : 1,2 : 0,6 = 1 : 2 : 1
Chọn x = 1 → công thức đơn giản nhất của A là CH 2 O