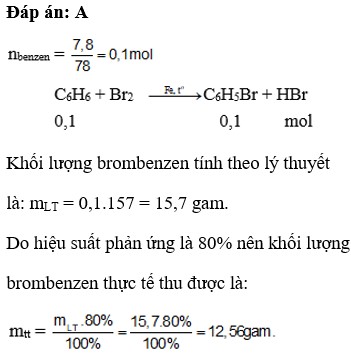
Khi có mặt bột sắt, benzen phản ứng với clo tương tự như phản ứng với brom. Hãy tính lượng clobenzen thu được khi cho 15,6 gam benzen tác dụng với clo dư khi có mặt bột Fe và đun nóng. Biết hiệu suất phản ứng đạt 80%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phương trình hoá học của phản ứng giữa benzen và clo
\(C_6H_6+Cl_2\xrightarrow[t^o]{Fe}C_6H_5Cl+HCl\)
Theo phương trình hoá học : số mol C6H6 = số mol C6H5Cl.
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
\(n_{C6H5Cl}=\dfrac{15,6}{78}.\dfrac{80}{100}=0,16mol\Rightarrow m_{C5H5Cl}=0,16.112,5=18g\)
Phương trình hoá học của phản ứng giữa benzen và clo
C6H6+Cl2\(\xrightarrow[t^0]{FE}\)C6H5Cl+HCl
Theo phương trình hoá học : số mol C6H6 = số mol C6H5Cl.
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
nC6H5Cl=15,678×80100=0,16(mol)⇒mC5H5Cl=0,16×112,5=18(gam)

Phương trình hoá học của phản ứng giữa benzen và clo:
\(C_6H_6+Cl_2\xrightarrow[t^{.0}]{Fe}C_6H_5Cl+HCl\)
Theo phương trình hoá học : số mol C6H6 = số mol C6H5Cl.
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
\(n_{C_6H_5Cl}=\dfrac{15,6}{78}.\dfrac{8}{100}=0,16\left(mol\right)\Rightarrow m_{C_5H_5Cl}=0,16.112,5=18\left(g\right)\)
Phương trình hoá học của phản ứng giữa benzen và clo
C6H6+Cl2\(\xrightarrow[t^0]{FE}\)C6H5Cl+HCl
Theo phương trình hoá học : số mol C6H6 = số mol C6H5Cl.
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
nC6H5Cl=15,678×80100=0,16(mol)⇒mC5H5Cl=0,16×112,5=18(gam)

\(n_{C_6H_5Cl}=\dfrac{78}{112,5}=\dfrac{52}{75}\left(mol\right)\)
\(n_{C_6H_6}=\dfrac{78}{78}=1\left(mol\right)\)
PTHH:
\(C_6H_6+Cl_2\xrightarrow[t^o]{Fe}C_6H_5Cl\)
1------------------>1
\(\Rightarrow H=\dfrac{\dfrac{52}{75}}{1}.100\%=69,33\%\)

nclobenzen=0.6933 mol
=> H = 69.33% ( bài này đối với Cl tác dụng với 87g benzen nha)

Đáp án A
Hướng dẫn nbenzen = 1 mol; nclobenzen = 0,6933 mol => H = 69,33%

\(C_6H_6+Cl_2\) ( Xúc tác bột Fe ) \(\rightarrow C_6H_5Cl\)
nC6H6 = 0,2 mol.
Suy ra:
nC6H5Cl = 0,2 mol.
mC6H5Cl = 0,2.112,5.0,8 = 18 (g)
C6H6 + Cl2 (Xúc tác bột Fe) → C6H5Cl
nC6H6 = 0,2 mol.
Suy ra:
nC6H5Cl = 0,2 mol.
mC6H5Cl = 0,2.112,5.0,8 = 18 (g)

nC6H6 = 0,3 mol
C6H6 + Br2 → C6H5Br + HBr
0,3........................0,3
⇒ mC6H5Br = 0,3.157.\(\dfrac{90}{100}\) = 42,39 (g)
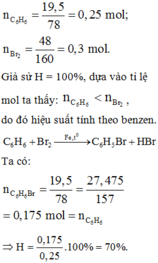
Phương trình hoá học của phản ứng giữa benzen và clo
C 6 H 6 + Cl 2 → t ° C 6 H 5 Cl + HCl
Theo phương trình hoá học : số mol C 6 H 6 = số mol C 6 H 5 Cl
Vì hiệu suất 80% và clo dư nên số mol clobenzen thu được là :
n C 6 H 5 Cl = 15,6/78 x 80/100 = 0,16mol
=> m C 6 H 5 Cl = 0,16 x 112,5 = 18g