16,9 gam hỗn hợp Na, Al hòa tan hết vào nước dư, thu được dung dịch X. Cho X phản ứng vừa hết 0,8 mol HCl, thu được 7,8 gam kết tủa và dung dịch Y. Tính khối lượng Al ban đầu.
A. 2,7 gam
B. 3,95 gam
C. 5,4 gam
D. 12,4 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
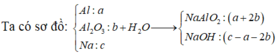
Khi cho 0,06 mol HCl ⇒ m gam kết tủa. Thêm tiếp vào (0,13–0,06) = 0,07 mol thì số mol kết tủa giảm 0,01 mol.
⇒ Khi cho 0,06 mol HCl vào thì kết tủa chưa đạt cực đại. Với 0,13 mol HCl thì số mol kết tủa đã đạt cực đại và bị hòa tan lại.
⇒ Sau khi phản ứng với 0,06 mol HCl thì số mol NaAlO2 còn lại = 0 , 07 - 0 , 01 × 3 4 = 0 , 01 m o l
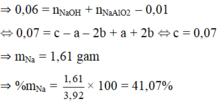

Giải thích:
Na : x mol ; Al : y mol và Al2O3 : z mol
→ 23x + 27y + 102z = 9,8
Na + H2O → NaOH + ½ H2
2NaOH + 2Al + H2O→ NaAlO2 + 3H2
2NaOH + Al2O3 → 2NaAlO2 + H2O
→ dung dịch Y có NaAlO2 : y + 2z mol, NaOH : x – y - 2z
Y + HCl
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
∆nHCl = 0,195 mol
Kết tủa có m2 < m1
→ TH2 tạo kết tủa hoàn toàn rồi tan một phần
→ nHCl(1) = x – y – 2z + n↓(1)
nHCl(2) = x – y – 2z + y + 2z + 3. ( y + 2z – n↓(2))
→ n↓(2) – n↓(1) = - 0,025
= ![]() → x = 0,16
→ x = 0,16
→%Na= 37,55%
Đáp án B

Chọn C.
Ta có:
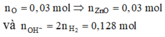
mà ZnO + 2OH- Þ OH- dư: 0,128 – 0,06 = 0,068 mol. Khi cho Y tác dụng với HCl:
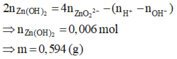

Định hướng tư duy giải
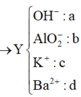

=> 0,11.35,5 + 96(0,04 – d) + 39c + 9(0,19 – 2d – c) = 10,775
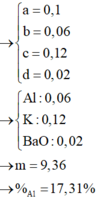

Định hướng tư duy giải
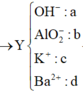

=> 0,3.35,5 + 96(0,06 – d) + 39c + 9(0,42 – 2d – c) = 22,35

Định hướng tư duy giải
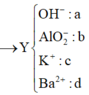

=> 0,12.35,5 + 96(0,04 – d) + 39c + 9(0,2 – 2d – c) = 9,42.
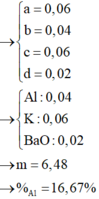
Đáp án C
Vì phản ứng của dung dịch X với HCl thu được kết tủa nên HCl đã hết.
● Nếu dung dịch Y chỉ có NaCl, suy ra :
● Nếu dung dịch Y có NaCl và NaAlO 2 thì :
Vậy dung dịch thu sau toàn bộ quá trình phản ứng có chứa NaCl và AlCl 3 .
Theo bảo toàn điện tích và bảo toàn nguyên tố Al, ta có :
3 n Al 3 + ⏟ x + n Na + ⏟ y = n Cl - = 0 , 8 27 n Al 3 + ⏟ x + 23 n Na + ⏟ y = 16 , 9 - 0 , 1 . 27 ⏟ m Al trong kết tủa = 14 , 2 ⇒ x = 0 , 1 y = 0 , 5 ⇒ n Al bđ = 0 , 2 mol m Al bđ = 5 , 4 gam