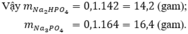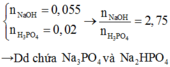Cho 48g dung dịch NaOH 10% tác dụng với 10g dung dịch axit photphoric 39,2 %. Khối lượng muối thu được sau phản ứng là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
n N a O H = 44 . 10 100 . 40 = 0 , 11 m o l ; n H 2 P O 4 = 20 . 39 , 2 100 . 98 = 0 , 08 m o l
T = 0 , 11 0 , 08 = 1 , 375
1 < T < 2
→ muối thu được sau phản ứng là NaH2PO4 và Na2HPO4

Ta có: \(C_{\%_{NaOH}}=\dfrac{m_{NaOH}}{44}.100\%=10\%\)
=> mNaOH = 4,4(g)
=> \(n_{NaOH}=\dfrac{4,4}{40}=0,11\left(mol\right)\)
Ta lại có: \(C_{\%_{H_3PO_4}}=\dfrac{m_{H_3PO_4}}{10}.100\%=39,2\%\)
=> \(m_{H_3PO_4}=3,92\left(g\right)\)
=> \(n_{H_3PO_4}=\dfrac{3,92}{98}=0,04\left(mol\right)\)
PTHH: 3NaOH + H3PO4 ---> Na3PO4 + 3H2O
Ta thấy: \(\dfrac{0,11}{3}< \dfrac{0,04}{1}\)
Vậy H3PO4 dư.
Theo PT: \(n_{Na_3PO_4}=\dfrac{1}{3}.n_{NaOH}=\dfrac{1}{3}.0,11=\dfrac{11}{300}\left(mol\right)\)
=> \(m_{Na_3PO_4}=\dfrac{11}{300}.164=6,01\left(3\right)\left(g\right)\)
Ta có; \(m_{dd_{Na_3PO_4}}=44+10=54\left(g\right)\)
=> \(C_{\%_{Na_3PO_4}}=\dfrac{6,01\left(3\right)}{54}.100\%=11,14\%\)

a) $n_{H_2SO_4} = \dfrac{490.10\%}{98} = 0,5(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Theo PTHH :
$n_{NaOH} = 2n_{H_2SO_4} = 1(mol)$
$\Rightarrow m_{dd\ NaOH} = \dfrac{1.40}{20\%} = 200(gam)$
\(n_{H_2SO_4}=\dfrac{490.10\%}{98}=0,5\left(mol\right)\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ n_{NaOH}=0,5.2=1\left(mol\right)\\ m_{ddNaOH}=\dfrac{1.40.100}{20}=200\left(g\right)\)

Chọn C
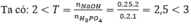
Sau phản ứng thu được hai muối: Na 2 HPO 4 ( x mol ) và Na 3 PO 4 (y mol)
Bảo toàn Na có: 2x + 3y = 0,5 (1)
Bảo toàn P có: x + y = 0,2 (2)
Từ (1) và (2) có x = y = 0,1.