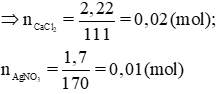Câu 3/ Trộn 300ml dung dịch có chứa 22,2 g CaCl2 với 700 ml dung dịch có chứa 17 g AgNO3. a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học. b) Tính khối lượng chất rắn sinh ra. c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) dung dịch xuất hiện kết tủa trắng ( AgCl )
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
b)
CaCl2 + 2AgNO3 --> Ca(NO3)2 + 2AgCl
Tpu 0.02 0.01
Pu 0.005 0.01 0.01 0.02
Spu 0.015 0.01 0.02
n CaCl2= m/M= 2.22/ 111= 0.02 (mol)
n AgNO3= 1.7 / 170= 0.01 (mol)
Ta có: 0.02/ 1 > 0.01/ 2 => CaCl2 dư, AgNO3 hết
m AgCl = 0.02 * 143.5 = 2.87 (g) => m kết tủa = 2.87 g
c) Tổng thể tích 2 dung dịch là:
V = 0.03 + 0.07= 0.1 ( lít )
Nồng độ mol của dung dịch CaCl dư:
CM ( CaCl2 ) = 0.015/ 0.1 = 0.15 M
Nồng độ mol của dung dịch Ca(NO3) tạo thành sau phản ứng là:
CM [ Ca(NO3)2 ] = 0.01/ 0.1 = 0.1 M

Phương trình phản ứng
CaCl2 (dd) + 2AgNO3 -> 2AgCl (r ) + Ca(NO3)2 (dd)
a) Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) Đáp số
mAgCl=1,435 gam
c) Trong 30 + 70 = 100 (ml) dd sau phản ứng có chứa 0,02 – 0,05 =0,015 (mol) CaCl2 dư và 0,005 mol Ca(NO3)2
Do vậy ta có
CMCaCl2=0,15M và CMCa(NO3)2 = 0,05 M.
a) Phương trình phản ứng CaCl2(dd) + 2AgNO3 → 2AgCl (r) + Ca(NO3)2 (dd)
Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
b) MCaCl2 = 40 + 35,5. 2 = 111g/mol ; MAgNO3 = 108 + 14 + 16.3 = 170g / mol
Tỉ lệ mol: 0,02/1 > 0,01/2 ⇒ AgNO3 phản ứng hết, CaCl2 dư.
Theo pt: nAgCl = nAgNO3 = 0,01 (mol) ⇒ mAgCl = 0,01. 143,5 = 1,435 (g)
c) Chất còn lại sau phản ứng: Ca(NO3)2 và CaCl2 dư
Theo pt:

a) Dần xuất hiện kết tủa trắng.
\(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgNO_3\)
\(b)n_{CaCl_2}=\dfrac{2,22}{111}=0,02mol\\ n_{AgNO_3}=\dfrac{1,7}{170}=0,01mol\\ \Rightarrow\dfrac{0,02}{1}< \dfrac{0,01}{2}\Rightarrow CaCl_2.dư\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\)
0,005 0,01 0,005 0,01
\(m_{AgCl}=0,01.143,5=1,435g\\ c)C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07}=\dfrac{1}{14}M\\ C_{M_{CaCl_2.dư}}=\dfrac{0,02-0,005}{0,07}=\dfrac{3}{14}M\)

a , Xuất hiện kết tủa màu trắng
PTHH : NaCl + AgNO3 -> NaNO3 + AgCl\(\downarrow\)
b , nNaCl = 0,02 (mol) , nAgNO3 = 0,01 (mol) => NaCl dư 0,01 (mol)
mAgCl = 0,01 . 143,5=1,435 (g)
c , Vdung dịch = 0,12 (l)
CM (NaCl) = 0,01/0,12=1/12(M) =CM(NaNO3)

a) Hiện tượng: sau khi phản ứng xuất hiện kết tủa
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓
b) \(n_{CaCl_2}=\dfrac{2,22}{111}=0,02\left(mol\right)\)
\(n_{AgNO_3}=\dfrac{1,7}{170}=0,01\left(mol\right)\)
Theo pT: \(n_{CaCl_2}=\dfrac{1}{2}n_{AgNO_3}\)
Theo bài: \(n_{CaCl_2}=2n_{AgNO_3}\)
Vì \(2>\dfrac{1}{2}\) ⇒ CaCl2 dư
b) Theo PT: \(n_{AgCl}=n_{AgNO_3}=0,01\left(mol\right)\)
\(\Rightarrow m_{AgCl}=0,01\times143,5=1,435\left(g\right)\)
Hiện tượng au pứ xuất hiện kết tủa: AgCl
nCaCl2=2,22/111=0,02mol
nAgNO3 = 1,7/170=0,01mol
pt : CaCl2 + 2AgNO3 ------> Ca(NO3)2 + 2AgCl
n có: 0,02 0,01
n pứ:0,005<--------0,01--------------------------->0,01
chất rắn sinh ra là AgCl
mAgCl=0,01.143,5=1,435g