Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn A. Cho A tác dụng với dung dịch HCl dư, thu được khí B. Tỉ khối của B so với không khí là
A. 0,8045
B. 0,7560
C. 0,7320
D. 0,9800
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

E nung tạo 2 oxit , Mà A chứa 3 cation => E có 3 hidroxit
A chứa 3 cation => đó là : Fe2+ ;Fe3+;Cu2+. Các phản ứng : Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Fe2+ + Ag+ → Fe3+ + Ag
Để thỏa mãn đề thì Fe2+ phải dư hơn so với Ag+
=> c/3 < a < c/2
=>B

Đáp án C
Ta có:
Fe + 2HCl→ FeCl2 + H2
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
![]()
![]()
Bảo toàn Fe: nFe bđ = 0,2 + 0,2.3 = 0,8
2Fe → Fe2O3
0,8 → 0,4
=> m = 0,4.160 = 64 (g)

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
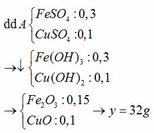

Xét `a<b->H` tính theo `Fe.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5a->0,5a->0,5a(mol)`
Có `n_{Fe\ pu}=0,5a(mol)`
`Y` gồm `Fe:0,5a(mol);S:b-0,5a(mol);FeS:0,5a(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5a(mol);n_{H_2}=n_{Fe}=0,5a(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5a}/{0,5a}=1/3` vô lí.
Xét `a>b->H` tính theo `S.`
`Fe+S` $\xrightarrow{t^o}$ `FeS`
`0,5b←0,5b->0,5b(mol)`
Có `n_{S\ pu}=0,5b(mol)`
`Y` gồm `Fe:a-0,5b(mol);S:0,5b(mol);FeS:0,5b(mol)`
`FeS+2HCl->FeCl_2+H_2S`
`Fe+2HCl->FeCl_2+H_2`
Theo PT: `n_{H_2S}=n_{FeS}=0,5b(mol);n_{H_2}=n_{Fe}=a-0,5b(mol)`
`->{n_{H_2S}}/{n_{H_2}}={5.2-2}/{34-5.2}=1/3`
``->{0,5b}/{a-0,5b}=1/3`
`->1,5b=a-0,5b`
`->a=2b`
`->a:b=2:1`
Đáp án A