Hòa tan 8,4 gam Fe bằng dung dịch HCl dư, thu được V lít khí H 2 (đktc). Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 1,12
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(Ba+2HCl \to BaCl_2+H_2\\ n_{Ba}=\frac{13,7}{137}=0,1(mol)\\ n_{H_2}=n_{Ba}=0,1(mol)\\ V_{H_2}=0,1.22,4=2,24(l)\\ \text{Vậy chon đáp án C }\)

Mg+ 2HCl→ MgCl2+ H2
(mol) 0,2 0,2
\(n_{Mg}=\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
→\(V_{H_2}=n.22,4=0,2.22,4=4,48\left(lít\right)\)
Vậy giá trị của V là 4,48. Chọn câu A

Đáp án D
%Fe = 100% - 43,24% = 56,76%
Khối lượng của Fe là
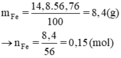
Fe + 2HCl → FeCl2 + H2
0,15(mol) 0,15(mol)
VH2 = 0,15 x 22,4 = 3,36 (lit)

Chọn B.
Phương trình: Fe + 2HCl → FeCl2 + H2.
Số mol H2 = 0,1 mol → số mol Fe = 0,1 mol → m = 5,6 gam.

Đáp án A
Phương trình: Fe + 2HCl → FeCl2 + H2.
Số mol H2 = 0,1 mol → số mol Fe = 0,1 mol → m = 5,6 gam.

Đáp án A
Phương trình: Fe + 2HCl → FeCl2 + H2.
Số mol H2 = 0,1 mol → số mol Fe = 0,1 mol → m = 5,6 gam.