Bài 1/ Nguyên tố X có STT 20, chu kì 4, nhóm IIA. Hãy cho biết:- Số proton, số electron trong nguyên tử X?- Số lớp electron trong nguyên tử X?- Số eletron lớp ngoài cùng trong nguyên tử X? Bài 2/ Cấu hình electron nguyên tử của một nguyên tố Y là: 1s22s22p63s23p5.Hãy cho biết vị trí của nguyên tố Y trong bảng tuần hoàn (ô, chu kỳ, nhóm) của Y trong bảng tuần hoàn (có giải thích)? Bài tập 3/ Nguyên tố X có...
Đọc tiếp
Bài 1/ Nguyên tố X có STT 20, chu kì 4, nhóm IIA. Hãy cho biết:
- Số proton, số electron trong nguyên tử X?
- Số lớp electron trong nguyên tử X?
- Số eletron lớp ngoài cùng trong nguyên tử X?
Bài 2/ Cấu hình electron nguyên tử của một nguyên tố Y là: 1s22s22p63s23p5.
Hãy cho biết vị trí của nguyên tố Y trong bảng tuần hoàn (ô, chu kỳ, nhóm) của Y trong bảng tuần hoàn (có giải thích)?
Bài tập 3/ Nguyên tố X có STT 7, chu kì 2, nhóm VA và nguyên tố Y có STT 13, chu kì 3, nhóm III A
Hãy cho biết các tính chất của nguyên tố X và Y:
- Là kim loại hay phi kim? Vì sao?
- Hóa trị cao nhất trong hợp chất với oxi?
- Hóa trị trong hợp chất với hidro (nếu có)?
- Công thức oxit cao nhất?
- Công thức hợp chất khí với hidro (nếu có) ?
- Công thức hidroxit tương ứng?

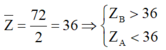
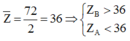
Đáp án D
Hướng dẫn X thuộc nhóm IA,IIA nên có điện hóa trị +1,+2
Y thuộc cùng nhóm VIA,VIIA nên Y có điện hóa trị -2 và -1
Ngoài ra ZX + ZY = 20. Vì X, Y thuộc hai chu kì kế cận nên nghiệm thích hợp là
ZX = 11 thì ZY = 9 ; X là Na , Y là F và XY là NaF
ZX = 12 thì ZY = 8 ; X là Mg , Y là O và XY là MgO