Một bình kín dung tích không đổi chứa hỗn hợp cùng thể tích khí N2 và H2 ở 0oC, 100atm. Sau khi tiến hành tổng hợp NH3, đưa nhiệt độ bình về 0oC, áp suất mới của bình là 90atm. Hiệu suất phản ứng tổng hợp NH3 là:
A. 10%
B. 25%
C. 20%
D. 30%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Đặt nC2H4 ban đầu = x mol; nH2 = y mol.
Ta có MY = 18 → H2 dư; hhY gồm C2H6 và H2 dư.
Theo BTKL: mX = mY = 28x + 2y gam.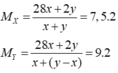
→ y = 5x → hhY gồm x mol C2H6 và 4x mol H2.
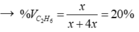

a) Giả sử các khí đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol N2, H2 ban đầu là a, b (mol)
=> a + b = 50 (1)
Gọi số mol N2 pư là x (mol)
PTHH: N2 + 3H2 --to,xt--> 2NH3
Trc pư: a b 0
Pư: x---->3x----------->2x
Sau pư (a-x) (b-3x) 2x
=> a + b - 2x = 44
=> x = 3 (mol)
Có \(n_{N_2\left(sau.pư\right)}=a-x=44.25\%=11\left(mol\right)\)
=> a = 14 (mol)
=> b = 36 (mol)
\(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{14}{50}.100\%=28\%\\\%V_{H_2}=\dfrac{36}{50}.100\%=72\%\end{matrix}\right.\)
Y chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\end{matrix}\right.\)
Z chứa \(\left\{{}\begin{matrix}N_2:11\left(mol\right)\\H_2:27\left(mol\right)\\NH_3:6\left(mol\right)\\N_2O:6\left(mol\right)\end{matrix}\right.\)
\(Z\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{11}{11+27+6+6}.100\%=22\%\\\%V_{H_2}=\dfrac{27}{11+27+6+6}.100\%=54\%\\\%V_{NH_3}=\dfrac{6}{11+27+6+6}.100\%=12\%\\\%V_{N_2O}=\dfrac{6}{11+27+6+6}.100\%=12\%\end{matrix}\right.\)
b)
11,2 lít hh Z ở đktc chứa \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{11,2.22\%}{22,4}=0,11\left(mol\right)\\n_{H_2}=\dfrac{11,2.54\%}{22,4}=0,27\left(mol\right)\\n_{NH_3}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\\n_{N_2O}=\dfrac{11,2.12\%}{22,4}=0,06\left(mol\right)\end{matrix}\right.\)
=> mZ = 0,11.28 + 0,27.2 + 0,06.17 + 0,06.44 = 7,28 (g)

Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2
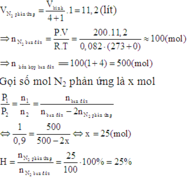

Chọn B. nhh= 500 mol → nN2= 100 mol ; nH2= 400 mol.
N2 + 3H2 → 2NH3
| Mol đầu |
100 |
400 |
0 |
| Mol pứ |
x |
3x |
0 |
| Mol cb |
100-x |
400-3x |
2x |
n hh sau = (400-2x) mol
Đề cho
n1.P2=n2.P1 bới P2=0,95P1
0,95.400= 400-2x
x= 12,5 mol.
Tính hiệu suất theo N2 → H%= 12,5 % (Tính hiệu suất theo chất nào mà kết quả ra cao hơn)

\(M_A=5.2=10\left(g/mol\right)\)
Do các khí đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích cũng là tỉ lệ mol
Chọn \(\left\{{}\begin{matrix}n_{H_2}=17,5\left(mol\right)\\n_{N_2}=5\left(mol\right)\end{matrix}\right.\)
Gọi \(n_{N_2\left(p\text{ư}\right)}=a\left(mol\right)\left(0< a< 5\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
a---->3a---------->2a
Xét tỉ lệ: \(5< \dfrac{17,5}{3}\Rightarrow\) Hiệu suất phản ứng tính theo N2
Ta có: \(n_A=5+17,5+2a-a-3a=22,5-2a\left(mol\right)\)
Theo ĐLBTKL: \(m_A=5.28+17,5.2=175\left(g\right)\)
\(\Rightarrow M_A=\dfrac{175}{22,5-2a}=10\Leftrightarrow a=2,5\left(TM\right)\)
\(\Rightarrow H=\dfrac{2,5}{5}.100\%=50\%\)
Đáp án D
Đặt nH2= nN2= a mol (ban đầu)
→ Tổng số mol khí ban đầu n1= a+a=2a (mol)
Do nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
Đặt nH2 pứ= x mol
N2 + 3H2 ⇌ 2NH3
Ban đầu a a mol
Phản ứng x/3 x 2x/3 mol
Sau pứ (a-x/3) (a-x) 2x/3 mol
Tổng số mol khí sau phản ứng n2= (a-x/3) + (a-x) + 2x/3= 2a- 2x/3 (mol)
Trong cùng điều kiện về nhiệt độ, tỉ lệ số mol bằng tỉ lệ áp suất