Đốt cháy hoàn toàn 8,8 gam FeS và 12 gam F e S 2 thu được khí. Cho khí này sục vào V ml dung dịch NaOH 25% (d=1,28 g/ml) được muối trung hòa. Giá trị tối thiểu của V là
A. 50 ml.
B. 75 ml
C. 100 ml.
D. 120 ml.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Hòa tan 21,9 gam X vào nước được 0,05 mol H2.
Do vậy thêm 0,05 mol O vào X được 22,7 gam X’ chứa BaO và Na2O.
Ta có: ![]()
Do vậy Y chứa 0,12 mol Ba(OH)2 và 0,14 mol NaOH.
Để thu được kết tủa nhiều nhất cần cho thêm 0,04 mol NaOH vào Z do vậy Z chứa 0,04 mol Ba(HCO3)2.
Vì thế BaCO3 0,08 mol.
Z còn chứa NaHCO3 0,14 mol
Bảo toàn C: ![]()

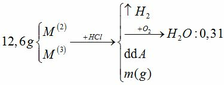
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
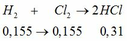
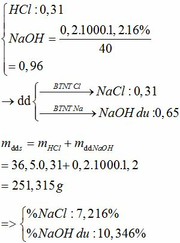

Đáp án A
Ta có :
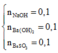
khi đó BTNT.S dễ thấy khi ,thì lượng kết tủa vẫn không thay đổi và vẫn là 21,7 gam.Vì sau khi S chui hết vào NaHSO3 nếu sục tiếp thì SO2 mới hòa tan kết tủa.
Như vậy,đáp án đề bài ra không hợp lý

nFe = 0,02 mol ; nCu = 0,03 mol → Σ ne cho = 0,02.3 + 0,03.2 = 0,12 mol ; nH+ = 0,4 mol ; nNO3– = 0,08 mol (Ion NO3– trong môi trường H+ có tính oxi hóa mạnh như HNO3)
- Bán phản ứng: NO3– + 3e + 4H+ → NO + 2H2O
Do (0,12/3)<(0,08/1)<(0,4/4)→ kim loại kết và H+ dư
0,12→ 0,16
→ nH+ dư = 0,4 – 0,16 = 0,24 mol → Σ nOH– (tạo kết tủa max) = 0,24 + 0,02.3 + 0,03.2 = 0,36 → V = 0,36 lít hay 360 ml → đáp án A
ta có:
nCu =0,03
nFe=0,02
Fe + 4H+ +NO3- ->Fe3+ + NO + 2H2O
0,02..0,08...0,02
3Cu + 8H+ +2NO3- -> 3Cu2+ +2NO +4H2O
0,03......0,08....0,02
=> nNaOH=0,24 + 0,02.3+0,03.2=0,36 mol
=> V=360ml
n F e S = 8,8/88 = 0,1 mol
⇒ n S O 2 (từ FeS) = 0,1 mol
n F e S 2 = 12/120 = 0,1 mol
⇒ n S O 2 (từ FeS2) = 0,1.2 = 0,2 mol
⇒ n S O 2 = 0,1+0,2 = 0,3 mol
Để chỉ thu được muối trung hòa thì giá trị tối thiểu của NaOH là:
n N a O H = 2.nSO2 = 0,6 mol
⇒ m N a O H = 0,6.40 = 24g
⇒ m d d N a O H = 24.100/25 = 96g
⇒ V d d N a O H = 96/1,28 = 75ml
⇒ Chọn B.