Hòa tan hỗn hợp A thu được từ sự nung bột Al và S bằng dung dịch HCl lấy dư thấy còn lại 0,04 gam chất rắn và có 1,344 lít khí bay ra ở đktc. Cho toàn bộ khí đo đi quan dung dịch Pb(NO3)2 lấy dư, sau phản ứng thu được 7,17 gam kết tủa màu đen. Xác định phần trăm khối lượng Al và S trước khi nung.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Al + 3S —> Al2S3
Chất rắn X gồm Al2S3, Al dư và S dư. Khí gồm H2S và H2. Chất rắn không tan là S dư.
+)Khí với Pb(NO3)2:
H2S + Pb(NO3)2 —> PbS + 2HNO3
0,03………………..……….0,03
n khí = 0,06 —> nH2 = 0,06 – 0,03 = 0,03 (mol)
+) Chất rắn X với HCl dư:
Al2S3 + 6HCl —> 2AlCl3 + 3H2S
0,01…………….....................0,03
2Al + 6HCl —> 2AlCl3 + 3H2
0,02………………………….0,03
+) Nung Al với S:
2Al + 3S —> Al2S3
0,02…0,03…..0,01
mAl = (0,02 + 0,02).27 = 1,08 g
mS = 0,03.32 + 0,04 = 1 g

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\)\(\Rightarrow n_{Cu}=n_{CuO}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{CuO}=\dfrac{0,1\cdot80}{40}\cdot100\%=20\%\)
\(\Rightarrow\%m_{Fe_2O_3}=80\%\)

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ BT : e 0 , 2 . 3 + 2 . ( 0 , 2 - 0 , 1 ) = 0 , 2 x . 2 + 0 , 2 y (2). Từ (1), (2) suy ra: x = 1,5

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ B T : e 0 , 2 . 3 + 2 . 0 , 2 - 0 , 1 = 0 , 2 x . 2 + 0 , 2 y 2
Từ (1), (2) suy ra: x = 1,5

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

Đáp án A
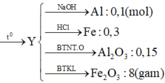
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Vì chia hỗn hợp Y thành hai phần bằng nhau nên số mol mỗi chất trong hai phần đều bằng nhau.
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên Y có Al.
Do đó Y có Al, Fe, A12O3 và có thể có Fe2O3.


ĐÁP ÁN D
Ban đầu, mkl = 0,75m , mO = 0,25m .nCO bđ = 0,06 mol. MZ = 36g => có CO và CO2
Áp dụng qui tắc đường chéo ta có : nCO2 = nCO = 0,03
=> nO trong oxit đã bị lấy = 0,03
=> nO còn = 0,25m/16 – 0,03 nHNO3 pư = 2nO + 4nNO = 0,25m/8 + 0,1 Bảo toàn N: nNO3 tạo muối = nHNO3 – nNO = 0,25m/8 + 0,06 m muối = mkl + mNO3-
=>3,08m = 62.(0,25m/8 + 0,06) + 0,75m m = 9,48g
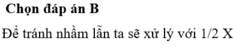

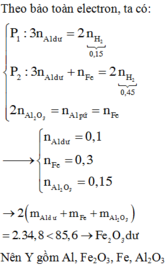
→ nH2 = 0,03
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
0,01 ← 0,03
2Al + 6HCl → 2AlCl3 + 3H2↑
→ nH2 = 0,03 → nAl = 0,02
2Al + 3S → Al2S3
Pư: 0,02 0,03 ←0,01
Dư: 0,02 0,00125
Bđ: 0,04 0,03125
=> %Al = 51,92%
%S = 48,08%