Đốt hoàn toàn m gam F e S 2 trong oxi dư thu được 2,24 lít khí S O 2 (đktc). Giá trị của m là
A. 6g.
B. 1,2g.
C. 12g.
D. 60g.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

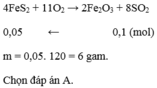

\(n_{H_2S\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ PTHH:2H_2S+3O_2-^{t^o}>2SO_2+2H_2O\)
tỉ lệ: 2 : 3 : 2 : 2
n(mol) 0,5---->0,75------>0,5------->0,5
\(m_{SO_2}=n\cdot M=0,5\cdot64=32\left(g\right)\)

Ta có: \(n_C=n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\Rightarrow n_H=0,4.2=0,8\left(mol\right)\)
\(n_{N_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_N=0,1.2=0,2\left(mol\right)\)
Ta có: mA = mC + mH + mN = 0,3.12 + 0,8.1 + 0,2.14 = 7,2 (g)

Chọn đáp án B
Cách 1: Biến đổi peptit – giải đốt cháy kết hợp thủy phân
đốt muối T dạng C n H 2 n N O 2 N a + O 2 → N a 2 C O 3 + 38,07 gam C O 2 + H 2 O + 0,1 mol N 2 .
⇒ có n T = 0,2 mol ⇒ n N a C O 3 = 0,1 mol ⇒ n C = n H 2 = (38,07 + 0,1 × 44) ÷ (44 + 18) = 0,685 mol.
⇒ m T = 0,685 × 14 + 0,2 × (46 + 23) = 23,39 gam. Quan sát lại phản ứng thủy phân:
m gam E + 0,2 mol NaOH → 23,39 gam muối T + x mol H 2 O .
đốt m gam E cho 0,63 mol H 2 O ||⇒ bảo toàn H có 2x = 0,09 mol ⇒ x = 0,045 mol.
⇒ BTKL phản ứng thủy phân có m = 0,045 × 18 + 23,39 – 0,2 × 40 = 16,20 gam → Chọn B. ♦.
Cách 2: tham khảo: tranduchoanghuy
Quy E về C 2 H 3 N O , C H 2 , H 2 O ⇒ T gồm C 2 H 3 N O 2 N a v à C H 2 .
⇒ n C 2 H 3 N O = n C 2 H 4 N O 2 N a = 2 n N 2 = 0,2 mol ⇒ n N a C O 3 = 0,1 mol.
⇒ n H 2 O = (38,07 + 0,1 × 44) ÷ (44 + 18) = 0,685 mol ⇒ n C H 2 = 0,285 mol.
Bảo toàn H có: n H 2 O trong E = (0,63 × 2 – 0,2 × 3 – 0,285 × 2) ÷ 2 = 0,045 mol.
⇒ m = 0,2 × 57 + 0,285 × 14 + 0,045 × 18 = 16,2 gam

Đáp án C
Vì Ca(OH)2 dư ⇒ nCaCO3 = nCO2 = 0,1 mol
⇒ mCaCO3 = 0,1 × 100 = 10 gam ⇒ Chọn C

Ta có sơ đồ phản ứng:
m(gam) (Mg, Fe) + --O2→ (m+4,16) gam B + --HCl→ D (Mg2+ x mol; Fe2+ y mol; Fe3+ z mol); Cl-)
D + --AgNO3→ (11m – 12,58) gam (Ag + AgCl)
Ta có m(O) = 4,16 gam → n(O) = 0,26 mol → n(Cl- trong D) = 0,52 mol
→ n(AgCl) = 0,52 mol
Ta có hệ phương trình
(1): 24x + 56(y+z) = m
(2) ĐLBT điện tích: 2x+2y+ 3z = 0,52
(3) m + 0,52*35,5 = 4m-6,5
→ m = 8,32 gam → n(Ag) = 0,04 = y → x = 0,16; z = 0,04
Mặt khác trong 4,5m gam A có: Mg = 0,72 mol và Fe 0,36 mol
Dung dịch muối: Mg2+: 0,72 mol; Fe3+: 0,36mol; NH4+: t mol; NO3-: q mol
hợp khí F gồm N2 (0,04 mol) và N2O (0,04 mol)
Áp dụng ĐLBT mol e: → t = 0,225 mol
Áp dụng ĐLBT điện tích → q = 2,745 mol → m 211,68 gam → Đáp án C