Khi nung nóng 2 mol natri đicromat người ta thu được 48 gam O2 và 1 mol crom (III) oxit. Hãy viết phương trình hóa học của phản ứng và xem xét natri đicromat đã bị nhiệt phân hoàn toàn chưa?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Na2Cr2O7 → 2Na2O + 2Cr2O3 + 3O2
Số mol O2 là 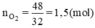
Số mol Na2Cr2O7 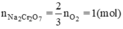
Nung 2 mol Na2Cr2O7 nếu thu 48 gam O2 thì chỉ nung hết 1 (mol). Do đó phản ứng chưa kết thúc.

Đáp án A
4Na2Cr2O7 → t 0 4Na2CrO4 + 2Cr2O3 + 3O2
Có

A + Ba(OH)2 → BaCrO 4 : 0 , 08 + 2 . 0 , 02 = 0 , 12 mol Cr 2 O 3 : 0 , 04 mol
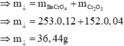

a, PTHH:
Fe2O3 + 3H2 ---to---> 2Fe + 3H2O (1)
CuO + H2 ---to---> Cu + H2O (2)
b, nFe = \(\dfrac{2,8}{56}=0,05\left(mol\right)\)
nCu = \(\dfrac{6-2,8}{64}=0,05\left(mol\right)\)
Theo pt (1): nH2 (1) = 2nFe = 2 . 0,05 = 0,1 (mol)
Theo pt (2): nH2 (2) = nCu = 0,05 (mol)
=> VH2 = (0,1 + 0,05) . 22,4 = 3,36 (l)
c, Theo pt (1): nCuO = nCu = 0,05 (mol)
Theo pt (2): nFe2O3 = \(\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}.0,05=0,025\left(mol\right)\)
=> m = 0,05 . 80 + 0,025 . 160 = 8 (g)
\(a.CuO+H_2-^{t^o}\rightarrow Cu+H_2O\\ Fe_2O_3+3H_2-^{t^o}\rightarrow2Fe+3H_2O\\ b.m_{Cu}=6-2,8=3,2\left(g\right)\\ n_{Cu}=0,05\left(mol\right);n_{Fe}=0,05\left(mol\right)\\ \Sigma n_{H_2}=n_{Cu}+\dfrac{3}{2}n_{Fe}=0,125\left(mol\right)\\ \Rightarrow V_{H_2}=2,8\left(l\right)\\ c.n_{CuO}=n_{Cu}=0,05\left(mol\right);n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,025\left(mol\right)\\ m_{hh}=m_{CuO}+m_{Fe_2O_3}=0,05.80+0,025.160=8g\)

a) Phương trình hóa học của các phản ứng:
4CO + Fe3O4 → 3Fe + 4 CO2 (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b)Theo phương trình phản ứng trên ta có:
Muốn khử 1 mol Fe3O4 cần 4 mol CO.
Muốn khử 0,2 mol Fe3O4 cần x mol CO.
x= 0,2.4 = 0,8 mol CO.
VCO = 0,8 .22,4 = 17,92 lít.
Muốn khử 1 mol Fe2O3 cần 3 mol H2.
Muốn khử 0,2 mol Fe2O3 cần y mol H2.
y = 0,2 .3 = 0,6 mol.
VH2= 0,6 .22,4 = 13,44l.
c) Ở phản ứng (1) khử 1 mol Fe3O4 được 3 mol Fe.
Vậy khử 0,2 mol Fe3O4 được 0,6 mol Fe.
mFe = 0,6 .56 = 33,6g Fe.
Ở phản ứng (2) khử 1 mol Fe2O3 được 2 mol Fe.
Vậy khử 0,2 mol Fe2O3 được 0,4 mol Fe.
mFe = 0,4 .56 = 22,4g Fe.

Gọi số mol CuO và Fe2O3 là a, b (mol)
=> 80a + 160b = 56 (1)
PTHH: CuO + H2 --to--> Cu + H2O
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
CuO + CO --to--> Cu + CO2
Fe2O3 + 3CO --to--> 2Fe + 3CO2
=> 64a + 112b = 43,2 (2)
(1)(2) => a = 0,5 (mol); b = 0,1 (mol)
\(n_{H_2\left(lý.thuyết\right)}=n_{CO\left(lý.thuyết\right)}=a+3b=\)0,8 (mol)
=> \(n_{H_2\left(tt\right)}=n_{CO\left(tt\right)}=\dfrac{0,8.120}{100}=0,96\left(mol\right)\)
=> \(V_{H_2\left(tt\right)}=V_{CO\left(tt\right)}=0,96.22,4=21,504\left(l\right)\)

Đáp án B
(NH4)2Cr2O7 → Cr2O3+ N2 + 4H2O
x mol x x 4x mol
mchất rắn giảm= mN2+ mH2O= 28x + 18.4x= 32-20
→ x= 0,12 mol; n(NH4)2Cr2O7 ban đầu=8/63 mol
H = npứ/ nban đầu. 100%= 94,5%

a)
nNa = 11,5 : 23 = 0,5 mol
4Na + O2 → 2Na2O
Theo tỉ lệ phương trình => nO2 phản ứng = 1/4nNa = 0,5 : 4 = 0,125 mol
=> VO2 phản ứng = 0,125.22,4 = 2,8 lít.
b)
Na2O + H2O → 2NaOH
nNa2O = 1/2 nNa = 0,25 mol
=> nNaOH = 2nNa2O = 0,5 mol
<=> CNaOH = 0,5 : 0,25 = 2M. Và A thuộc loại hợp chất bazơ.

$n_{O_2} = \dfrac{48}{32} = 1,5(mol)$
\(4Na_2Cr_2O_7\xrightarrow[]{t^o}4Na_2CrO_4+2Cr_2O_3+3O_2\)
2 1 1,5 (mol)
Theo phương trình trên, ta thấy phản ứng nhiệt phân hoàn toàn