Hòa tan hoàn toàn 2,81g hỗn hợp Fe2O3, MgO, Zno trong 500ml H2SO4 0,1m vừa đủ sau phản ứng tính thành phần phần trăm theo khối lượng vừa đủ của các oxit ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\( BTNT\left(H\right):n_{H_2SO_4}.2=n_{H_2O}.2\\ \Rightarrow n_{H_2O}=0,05\left(mol\right)\\ BTKL:m_{oxit}+m_{H_2SO_4}=m_{muối}+m_{H_2O}\\ \Rightarrow m_{muối}=2,81+0,05.98-0,05.18=6,81\left(g\right)\)

Đáp án D
Số mol H2SO4 là: n H 2 SO 4 = 0 , 5 . 0 , 1 = 0 , 05 mol
Gọi M2On là oxit chung cho các oxit trong X
Sơ đồ phản ứng :
![]()
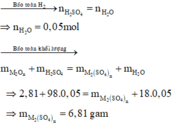

Đáp án C
nH2O = nH2SO4 = 0,05 mol
BTKL: m muối = moxit + mH2SO4 – mH2O = 2,81 + 0,05.98 – 0,05.18 = 6,81 gam

nH2O = nH2SO4 = 0,05 mol
BTKL: m muối = moxit + mH2SO4 – mH2O = 2,81 + 0,05.98 – 0,05.18 = 6,81 gam
Đáp án C

a)
- Gọi x, y lần lượt là số mol của \(CuO,ZnO\)
PTHH.
\(CuO+2HCl\rightarrow CuCl_2+H_2O\left(1\right)\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\left(2\right)\)
- Ta có hệ phương trình sau:
\(80x+81y=24,2\)
\(2x+2y=0,6\)
Giải hệ pt ta được: \(x=0,1\left(mol\right);y=0,2\left(mol\right)\)
\(\%m_{CuO}=\left(80.0,1:24,2\right).100\%=33,05\%\)
\(\%m_{ZnO}=100\%-33,05\%=66,95\%\)
200 ml =0,2 l
\(n_{HCl}=0,2.3=0,6\left(mol\right)\)
\(CuO+2HCl->CuCl_2+H_2O\left(1\right)\)
a 2a (mol)
\(ZnO+2HCl->ZnCl_2+H_2O\left(2\right)\)
b 2b (mol)
ta có
\(\begin{cases}80a+81b=24,2\\2a+2b=0,6\end{cases}\)
giả ra ta được a =0,1 (mol)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
thành phần % theo khối lượng mỗi oxit trong hỗn hợp ban đầu là
%CuO = \(\frac{8}{24,2}.100\%=33,06\%\)
%ZnO= 100% - 33,06% = 66,94%
Dung` DL BTKL: moxit + mH2SO4 = mmuoi' + mH2O
voi' nH2O = nH2SO4 = 0.5*0.1 = 0.05
--> mmuoi' = 2.81 + 0.05*98 - 0.05*18 = 6.81g
Cách 2 : (Fe2O3, MgO, ZnO) ----> (Fe2(SO4)3; MgSO4, ZnSO4)
--> nO = nSO4(2-) = nH2SO4 = 0.05
--> m(Fe, Mg, Zn) = 2.81 - mO = 2.81 - 0.05*16 = 2.01g
mmuoi' = mKL + mSO4(2-) = 2.01 + 0.05*96 = 6.81g