Hoà tan 4,8g Mg vào V (ml) dd H2SO4 0,5M vừa đủ. Hãy tính giá trị của V và thể tích khí sinh ra ở đktc?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


`1)`
`n_{Al}={2,7}/{27}=0,1(mol)`
`2Al+3H_2SO_4->Al_2(SO_4)_3+3H_2`
`0,1->0,15->0,05->0,15(mol)`
`V_{dd\ H_2SO_4}={0,15}/1=0,15(l)=150(ml)`
`->V=150`
`V'=V_{H_2}=0,15.22,4=3,36(l)`
`C_{M\ X}=C_{M\ Al_2(SO_4)_3}={0,05}/{0,15}=1/3M`
`2)`
`n_{Fe}={2,8}/{56}=0,05(mol)`
`Fe+2HCl->FeCl_2+H_2`
`0,05->0,1->0,05->0,05(mol)`
`V_{dd\ HCl}={0,1}/1=0,1(l)=100(ml)`
`->V=100`
`V_{H_2}=0,05.22,4=1,12(l)`
`C_{M\ FeCl_2}={0,05}/{0,1}=0,5M`

a) Mg + H2SO4 --> MgSO4 + H2
b) \(n_{Mg}=\dfrac{3}{24}=0,125\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,125->0,125-->0,125-->0,125
=> VH2 = 0,125.22,4 = 2,8 (l)
\(V_{dd.H_2SO_4}=\dfrac{0,125}{2}=0,0625\left(l\right)\)
c) Sản phẩm là Magie sunfat và khí hidro
\(m_{MgSO_4}=0,125.120=15\left(g\right)\)
mH2 = 0,125.2 = 0,25 (g)
d)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,125}{1}\) => Hiệu suất tính theo H2
Gọi số mol CuO bị khử là a (mol)
PTHH: CuO + H2 --to--> Cu + H2O
a--->a-------->a
=> 16 - 80a + 64a = 14,4
=> a = 0,1 (mol)
=> nH2(pư) = 0,1 (mol)
=> \(H=\dfrac{0,1}{0,125}.100\%=80\%\)

a) Mg+ 2H2SO4→ MgSO4+ SO2+ 2H2O
(mol) 0,2 0,4 0,2
nMg=\(\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
V SO2= n.22,4= 0,2.22,4= 4,48 (lít)
b) Ta có: CM H2SO4= \(\dfrac{n}{V}\)
<=> V H2SO4= \(\dfrac{n}{C_M}\)=\(\dfrac{0,4}{2}=0,2\left(lít\right)\)
Số mol của magie
nMg = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Pt : Mg + H2SO4 → MgSO4 + H2\(|\)
1 1 1 1
0,2 0,2 0,2
a) Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
b) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của dung dịch axit sunfuric đã dùng
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=n.C_M=0,2.2=0,4\left(l\right)\)
Chúc bạn học tốt

a.
\(m_{Ag}=m_{k.tan}=8,7\left(g\right)\\ m_{Zn,Mg}=20-8,7=11,3\left(g\right)\\ \left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ \rightarrow\left\{{}\begin{matrix}65a+24b=11,3\\a+b=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{8,7}{20}.100=43,5\%\\\%m_{Mg}=\dfrac{24.0,2}{20}.100=24\%\\\%m_{Zn}=\dfrac{0,1.65}{20}.100=32,5\%\end{matrix}\right.\)
b.
\(n_{H_2SO_4\left(tổng\right)}=a+b=0,3\left(mol\right)\\ V_{ddH_2SO_4\left(tổng\right)}=\dfrac{0,3}{0,5}=0,6\left(lít\right)=600\left(ml\right)\)

PTHH: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Mol: 0,1 0,15
PTHH: Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
Mol: 0,1 0,1
\(\Rightarrow n_{SO_2}=0,15+0,1=0,25\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,25.22,4=5,6\left(l\right)\)
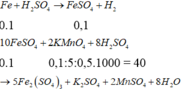

$n_{Mg}=\dfrac{4,8}{24}=0,2mol$
$PTHH :$
$Mg+H_2SO_4\to MgSO_4+H_2$\(\uparrow\)
$Theo\ pt :$
$n_{H_2SO_4}=n_{H_2}=n_{Mg}=0,2mol$
\(\Rightarrow\)$V=V_{dd\ H_2SO_4}=\dfrac{0,2}{0,5}=0,4l$
$V_{H_2}=0,2.22,4=4,48l$
H2 có bay hơi không ạ? (H2↑)