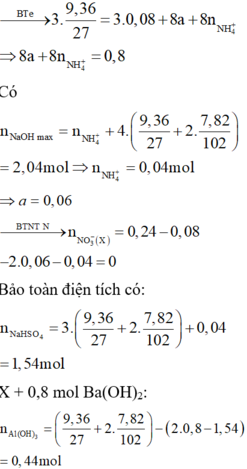Để trung hòa hết 250ml dung dịch A gồm HCl và H2SO4 cần 500ml Ba(oh)2 sau khi phản ứng kết thúc thu được 34,95 gam kết tủa. Mặt khác, cho 20,16 gam kim loại M tận tận hết vào 350ml dung dịch A thu được dung dịch B và 8,064 lít khí H2 duy nhất (ở đktc). Để trung hòa dung dịch B cần dùng 100ml dung dịch Ba(oh)2 nói trên l. Hãy tính nồng độ mol/l của dung dịch HCl H2SO4 Bà(oh)2 và xác định kim loại M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
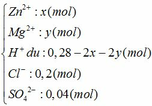
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
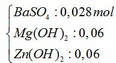
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

Đáp án C
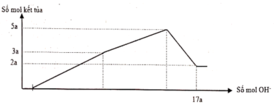
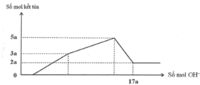
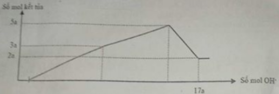
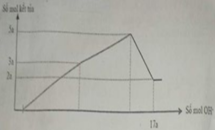
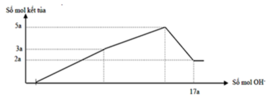
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
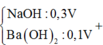


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

Giải thích:
Dd X + NaOH → Mg(OH)2 + Al(OH)3
Lượng kết tủa khi NaOH dư là nMg(OH)2 = 2a
→ lượng kết tủa tối đa là nAl(OH)3 = n↓ - nMg(OH)2 = 5a - 2a =3a
→ nMg : nAl2O3 = 2a : = 4 : 3
Mà mhỗn hợp = 24nMg + 102nAl2O3 = 12,06 → nMg = 0,12 mol và nAl2O3 = 0,09 mol
→ a = 0,06 mol → nOH = 17a = 1,02 = nH+ (X) + 2nMg + 8nAl2O3 = nH+(X) + 0,96 → nH+(X) = 0,06 mol
Bảo toàn điện tích trong dung dịch X có nH+(X) + 2nMg2+ + 3nAl3+ = nCl- + 2nSO4 = 0,84
Mà nCl : nSO4 = 5 : 1 nên nCl- = 0,6 mol và nSO4 = 0,12 mol
X có Cl- : 0,6 mol SO42- : 0,12 mol, H+ : 0,06 mol, Al3+ : 0,18 mol và Mg2+ : 012 mol
Dd thêm vào có Ba2+ : x mol, Na+ : 3x mol ; OH- : 5x mol
Để thu được kết tủa tối đa thì ta có tạo kết tủa Al(OH)3 và Mg(OH)2 tối đa
nOH- = 5x = 0,18.3 +0,12.2 =0,78 mol
Khi đó Ba2+ : 0,156 → nBaSO4= 0,12 → ↓ BaSO4 : 0,12 mol; Al(OH)3 : 0,18 mol; Mg(OH)2 : 0,12 mol
→ nung thu được 0,12 mol BaSO4; 0,09 mol Al2O3 và 0,12 mol MgO
→ m =41,94
Đáp án D

Đáp án B
Gọi số mol các ion K+, HCO3-, Cl- và Ba2+ có trong 100 ml dung dịch lần lượt là x, y, z, t mol
-Phần 1: HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
t y t mol = 0,1 mol
-Phần 2:
HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
y y = 0,15
-Phần 3:
Ag++ Cl-→ AgCl
2z 2z = 0,2 mol suy ra z = 0,1 mol
Theo ĐLBT ĐT thì: x+2t=y+z suy ra x=0,05 mol
đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
(39x+ 61y + 35,5.z+ 137t)/2= 14,175 gam