Cho 34,8 gam hỗn hợp X gồm Mg, Al, Fe(NO3)2 tan hoàn toàn trong 1,25 lít dung dịch NaHSO4 1M (vừa đủ). Sau khi các phản ứng hoàn toàn thu được dung dịch Y chỉ chứa m gam muối sunfat trung hòa và 5,6 lít (đktc) khí Z gồm 2 khí NO, NO2 có tỉ khối so với H2 là 19. tính % khối lượng của Fe(NO3)2 trong hỗn hợp X. Tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
M Y ¯ = 18 → Hỗn hợp Y gồm
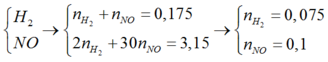
Sơ đồ phản ứng:
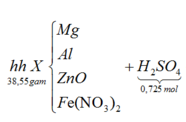
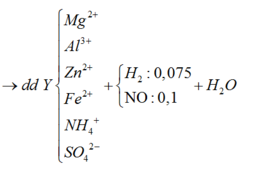
BTKL ta có khối lượng H2O = 9,9 (gam) à số mol H2O = 0,55 (mol)
BTNT (H) ta có số mol NH4+ = 0 , 725 . 2 + 0 , 55 . 2 + 0 , 075 . 2 4 = 0 , 05 ( m o l )
BTNT (N) à Số mol Fe(NO3)2 = 0 , 1 + 0 , 05 2 = 0 , 075 ( m o l )
BTNT (O) à Số mol ZnO = 0,2 (mol)
Đặt số mol Mg và Al trong X lần lượt là a và b ta có
24 a + 27 b = 8 , 85 2 a + 3 b = 0 , 85 → a = 0 , 2 ( m o l ) b = 0 , 15 ( m o l )
→ % n M g = 0 , 2 0 , 625 · 100 % = 32 %

Đáp án A
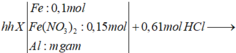
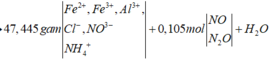
MZ = 16.2 = 32; nZ = 2,352 : 22,4 = 0,105 (mol)
NO: x
N2O : y
x + y = 0,105 (1)
30x + 44y = 32. 0,105 (2)
=> x = 0,09 ; y = 0,015 (mol)
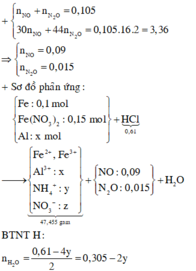
4H+ NO3- +3e → NO + H2O
10H+ + 2NO3- + 8e → N2O + 5H2O
10H+ + NO3- + 8e → NH4+ + 3H2O
BT electron: nH+ = 4nNO + 10nN2O + 10nNH4+
=> nNH4+ = (0,61- 4.0,09- 10.0,015):10 = 0,01 (mol)
BTNT H: nH+ = 4nNH4+ + 2nH2O
=> nH2O = (0,61 – 4. 0,01): 2 = 0, 285 (mol)
BTKL: mhh X + mHCl = mmuối + mhh khí + mH2O
=> ( 5,6 + 27 + m) + 0,61. 36,5 = 47,455 + 0,105. 32 + 0,285.18
=> m = 1, 08 g

Chọn đáp án A
n N O + n N 2 O = 0 , 105 m o l 30 n N O + 44 n N 2 O = 3 , 36 g
⇒ n N O = 0 , 09 m o l n N 2 O = 0 , 015 m o l
Do Y chỉ chứa các muối trung hòa nên H+ hết => Trong Y có muối amoni.
n N H 4 + = 0 , 61 - 0 , 09 . 4 - 0 , 015 . 10 10 = 0 , 01 ( m o l )
⇒ m = 1 , 08 gam

Chọn đáp án A.
Khí trong Z hóa nâu ngoài không khí là NO.
M Z = 4 , 5 . 4 = 18 < M NO => Khí còn lại có PTK < 18 => Khí đó là H2.

Đặt số mol của Mg, Al, ZnO lần lượt là x, y, z
Có khí H2 thoát ra nên sau phản ứng số mol Fe2+ không đổi.


Chọn đáp án D.
Khí hóa nâu ngoài không khí là NO.
M N O = 30 > 18 => Khí còn lại có phân tử khối < 18
=> Khí còn lại là H2.
⇒ n N O + n H 2 = 3 , 92 22 , 4 = 0 , 175 m o l 30 n N O + 2 n H 2 = 18 . 0 , 175 = 3 , 15 g
⇒ n N O = 0 , 1 m o l n H 2 = 0 , 075 m o l
Áp dụng bảo toàn khối lượng có:
m X + m H 2 S O 4 = m m u ố i + m k h í + m H 2 O
· Có
n H 2 O + n H 2 = 0 , 625 < n H 2 S O 4
=> Chứng tỏ có sản phẩm N H 4 + :
n N H 4 + = 0 , 725 . 2 - 0 , 625 . 2 4 = 0 , 05 m o l
· Áp dụng bảo toàn N có:
n F e N O 3 2 = n N H 4 + + n N O 2 = 0 , 075 m o l
· Áp dụng bảo toàn nguyên tố O có:
n Z n O + 6 n F e N O 3 2 = n N O + n H 2 O
⇒ n Z n O = 0 , 1 + 0 , 55 - 6 . 0 , 075 = 0 , 2 m o l
· Đặt số mol của Mg, Al lần lượt là a, b
![]()
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe (II).
Áp dụng bảo toàn electron có:
![]()
![]()
Suy ra a = 0 , 2 b = 0 , 15
⇒ % n M g = 32 %
Gần với giá trị 30 nhất.


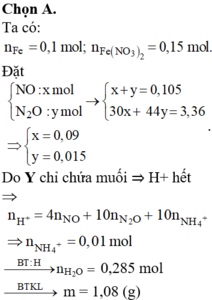

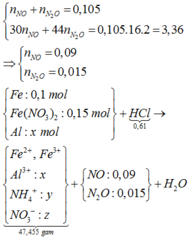
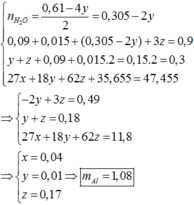


Đặt \(n_{NO}=x\left(mol\right);n_{NO_2}=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x+y=0,25\\30x+46y=0,25\cdot38\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,125\\y=0,125\end{matrix}\right.\)
Vai trò H+
4H+ + NO3- + 3e ------> NO + H2O
0,5____________________\(_{\leftarrow}\)0,125
2H+ + NO3- + e ------> NO2 + H2O
0,25____________________\(_{\leftarrow}\)0,125
10H+ + NO3- + 8e ------> NH4+ + H2O
0,5\(_{\rightarrow}\)_______________________0,05
\(BTNT.N\Rightarrow2n_{Fe\left(NO_3\right)_2}=n_{NO}+n_{NO_2}+n_{NH_4^+}=0,3\left(mol\right)\\ \Rightarrow n_{Fe\left(NO_3\right)_2}=0,15\left(mol\right)\Rightarrow m_{Fe\left(NO_3\right)_2}=27\left(g\right)\\ \Rightarrow\%Fe\left(NO_3\right)_2=77,59\%\)