Một hh A gồm Fe2O3 và Al2O3 có tỉ lệ mol tương ứng là 1:2. Tính thể tích khí H2 cần dùng( đktc) để khử hoàn toàn 18,2g hh A trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi số mol H2 là x
=> \(n_{H_2O}=x\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2}=m_B+m_{H_2O}\)
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> \(V_{H_2}=2,75.22,4=61,6\left(l\right)\)
b) Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_2O_3}=1,5a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{51}\)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,5.80}{200}.100\%=20\%\\\%m_{Fe_2O_3}=\dfrac{0,75.160}{200}.100\%=60\%\\\%m_{Al_2O_3}=\dfrac{\dfrac{20}{51}.102}{200}.100\%=20\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{2,75}{5}=0,55\left(mol\right)\)
\(n_{FeO\left(tt\right)}=\dfrac{36}{72}=0,5\left(mol\right)\)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> \(H\%=\dfrac{0,4}{0,5}.100\%=80\%\)

Bài 1:
a) PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+2H_2O\)
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
b) Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20\cdot80\%=16\left(g\right)\\m_{CuO}=20-16=4\left(g\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,35\left(mol\right)\) \(\Rightarrow V_{H_2}=0,35\cdot22,4=7,84\left(l\right)\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)\\n_{Cu}=n_{CuO}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hhB}=m_{Fe}+m_{Cu}=0,2\cdot56+0,05\cdot64=14,4\left(g\right)\)
Bài 2:
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
a) Vì khối lượng Cu bằng \(\dfrac{6}{5}\) khối lượng Fe
\(\Rightarrow\left\{{}\begin{matrix}m_{Cu}=\dfrac{26,4}{6+5}\cdot6=14,4\left(g\right)\\m_{Fe}=26,4-14,4=12\left(g\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=\dfrac{14,4}{64}=0,225\left(mol\right)\\n_{Fe}=\dfrac{12}{56}=\dfrac{3}{14}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2}=\dfrac{3}{2}n_{Fe}+n_{Cu}=\dfrac{9}{28}+0,225=\dfrac{153}{280}\left(mol\right)\) \(\Rightarrow V_{H_2}=\dfrac{153}{280}\cdot22,4=12,24\left(l\right)\)
b) Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{28}\left(mol\right)\\n_{CuO}=n_{Cu}=0,225\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=\dfrac{3}{28}\cdot160\approx17,14\left(g\right)\\m_{CuO}=0,225\cdot80=18\left(g\right)\end{matrix}\right.\) \(\Rightarrow m_{hh}=35,14\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{17,14}{35,14}\cdot100\%\approx48,78\%\\\%m_{CuO}=51,22\%\end{matrix}\right.\)

a) Gọi số mol H2 là x
=> nH2O=x(mol)
Theo ĐLBTKL: mA+mH2=mB+mH2O
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> VH2=2,75.22,4=61,6(l)
b) Gọi nCuO=a(mol)
nFe2O3=1,5a(mol)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{15}\)
%mCuO=\(\dfrac{0,5.80}{200}\).100%=20%
%mFe2O3=\(\dfrac{0,75.160}{200}\).100%=60%
%mAl2O3=\(\dfrac{\dfrac{20}{15}102}{200}\).100%=20%
c) nH2=\(\dfrac{2,75}{5}\)=0,55(mol)
nFeO(tt)=\(\dfrac{36}{72}\)=0,5(mol)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> H%=\(\dfrac{0,4}{0,5}\).100%=80%

Gọi \(\left\{{}\begin{matrix}n_{Fe_2O_3}=a\left(mol\right)\\n_{Al_2O_3}=2a\left(mol\right)\\n_{CuO}=3a\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
a ---------> 3a
CuO + H2 --to--> Cu + H2O
3a ------> 3a
\(\rightarrow3a+3a=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ \Leftrightarrow a=0,1\left(mol\right)\\ \rightarrow m=0,1.160+0,1.2.102+0,1.3.80=60,4\left(g\right)\)
Gọi \(n_{Fe_2O_3}=x\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al_2O_3}=2x\left(mol\right)\\n_{CuO}=3x\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
3x 3x
\(Al_2O_3+3H_2\rightarrow2Al+3H_2O\)
2x 6x
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
x 3x
\(\Rightarrow\Sigma n_{H_2}=3x+6x+3x=0,6\Rightarrow x=0,05mol\)
\(\Rightarrow m=m_{CuO}+m_{Al_2O_3}+m_{Fe_2O_3}\)
\(\Rightarrow m=3\cdot0,05\cdot80+2\cdot0,05\cdot102+0,05\cdot160=30,2g\)

\(\left\{{}\begin{matrix}CuO:a\\Fe2O3:2a\end{matrix}\right.\)
a.\(80a+320a=24\Leftrightarrow a=0.06\)
\(\Rightarrow\left\{{}\begin{matrix}CuO=0.06\\Fe2O3=0.12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}CuO=4.8g\\Fe2O3=19.2g\end{matrix}\right.\)
b.\(CuO+H2\rightarrow Cu+H2O\)
a a a
\(Fe2O3+3H2\rightarrow2Fe+3H2O\)
2a 6a 4a
\(\Rightarrow V_{H2}=\left(a+6a\right)\times22.4=9.408l\)
c.nHCl = 0.2 mol
\(Fe+2HCl\rightarrow FeCl2+H2\)
0.1 0.2
m chất rắn còn lại = mCu + m Fe ban đầu - m Fe bị hòa tan
= \(a\times64+4a\times56-0.1\times56=11.68g\)

\(Coi: n_{Cl_2} = 1(mol) \to n_{O_2} = 2(mol)\\ \%V_{Cl_2} = \dfrac{1}{1+2}.100\% = 33,33\%\\ \%V_{O_2} = 100\% -33,33\% = 66,67\%\\ M_A = \dfrac{1.71+2.32}{1+2}=45(g/mol)\\ d_{A/H_2} = \dfrac{45}{2} = 22,5\)
\(\text{Trong 6,72 lít khí A : }m_A = 45.\dfrac{6,72}{22,4}=13,5(gam)\)

\(n_{CuO}=2a\left(mol\right)\Rightarrow n_{Fe_2O_3}=a\left(mol\right)\)
\(m_X=80\cdot2a+160a=80\left(g\right)\)
\(\Rightarrow a=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(n_{H_2}=0.5+0.25\cdot3=1.25\left(mol\right)\)
\(V_{H_2}=1.25\cdot22.4=28\left(l\right)\)
\(m_{cr}=0.5\cdot64+0.5\cdot56=60\left(g\right)\)

\(m_{Fe_2O_3}=80\%.50=40\left(g\right)\Rightarrow n_{Fe_2O_3}=0,25\left(mol\right)\\ m_{CuO}=50-40=10\left(g\right)\Rightarrow n_{CuO}=0,125\left(mol\right)\\Fe_2O_3+3H_2-^{t^o}\rightarrow 2Fe+3H_2O\\ CuO+H_2-^{t^o}\rightarrow Cu+H_2O\\ \Sigma n_{H_2}=0,25.3+0,125=0,875\left(mol\right)\\ \Rightarrow V_{H_2}=0,875.22,4=19,6\left(l\right)\)
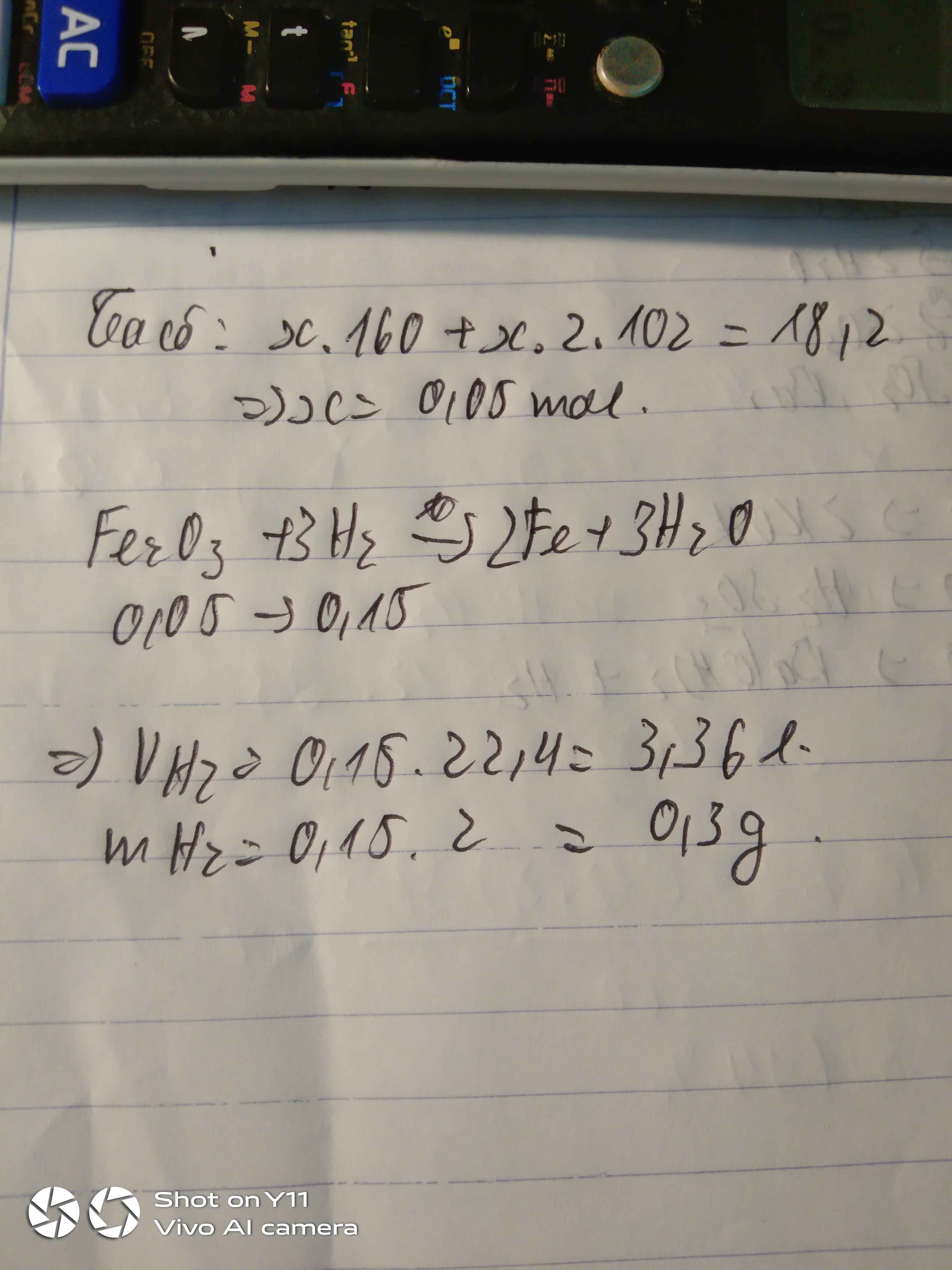
Gọi nFe2O3=a(mol)⇒nAl2O3=2a(mol)
⇒mA=160a+102.2a=18,2(gam)⇒a=0,05
Trong hỗn hợp A, chỉ có Fe2O3 tác dụng với H2
Fe2O3+3H2to→2Fe+3H2O
⇒nH2=3nFe2O3=0,05.3=0,15(mol)
⇒VH2=0,15.22,4=3,36(lít)
Hmm , hạn chế copy lại nhaaa :)) làm đúng sức mình vẫn là tốt hơn nè.