câu 3 Cho 1,82 gam hỗn hợp MgO và Al2O3 tác dụng vừa đủ với 250 ml dung dịch H2SO4 0,2M.
a) Viết phương trình phản ứng hóa học
b) Tính thành phần % khối lượng của mỗi oxit trong hỗn hợp.
Câu 4. Hòa tan 8 gam CuO trong 100 gam dung dịch H2SO4 19,6%.
a) Viết phương trình hóa học của phản ứng.
b) Tính nồng độ phần trăm của các chất trong dung dịch thu được.
Câu 5. Đốt cháy 1 kim loại hóa trị trong oxi dư thu được 5,6 gam oxit. Lượng oxit này có thể tác dụng hoàn toàn với 100ml dd HCl 2M. Tìm công thức hóa học của oxit.

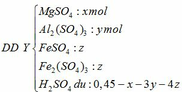
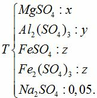
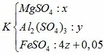

Câu 3:
Gọi x, y lần lượt là số mol của MgO và Al2O3
Ta có: \(n_{H_2SO_4}=0,2.250:1000=0,05\left(mol\right)\)
a. PTHH:
MgO + H2SO4 ---> MgSO4 + H2O (1)
Al2O3 + 3H2SO4 ---> Al2(SO4)3 + 3H2O (2)
b. Theo PT(1): \(n_{H_2SO_4}=n_{MgO}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2SO_4}=3.n_{Al_2O_3}=3y\left(mol\right)\)
=> x + 3y = 0,05 (1)
Theo đề, ta có: 40x + 102y = 1,82 (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}x+3y=0,05\\40x+102y=1,82\end{matrix}\right.\)
=> x = 0,02, y = 0,01
=> \(m_{MgO}=0,02.40=0,8\left(mol\right)\)
=> \(\%_{m_{MgO}}=\dfrac{0,8}{1,82}.100\%=43,96\%\)
\(\%_{m_{Al_2O_3}}=100\%-43,96\%=56,04\%\)
Câu 4:
Ta có: \(m_{H_2SO_4}=\dfrac{19,6\%.100\%}{100}=19,6\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Ta lại có: \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
a. PTHH: CuO + H2SO4 ---> CuSO4 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\)
Vậy H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\)
=> \(m_{CuSO_4}=0,1.160=16\left(g\right)\)
Ta có: \(m_{dd_{CuSO_4}}=8+100=108\left(g\right)\)
=> \(C_{\%_{CuSO_4}}=\dfrac{16}{108}.100\%=14,81\%\)
Câu 5: Thiếu đề