Cho 4,48 (l) khí hiđro(đktc)đi qua ống nghiệm chứa 23,3 (g) sắt từ oxit.
1) Viết phương trình hóa học của phản ứng.
2) Sau phản ứngchất nào còn dư,dư bao nhiêu (g).
3) Tính khối lượng hơi nước thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 16.8/56 = 0.3 (mol)
nO2 = 6.72/22.4 = 0.3 (mol)
2Fe + 3O2 -to-> Fe3O4
0.2___0.3________0.1
mFe dư = ( 0.3 - 0.2 ) * 56 = 5.6 (g)
mFe3O4 = 0.1*232 = 23.2 (g)
a)
3Fe+2O2→Fe3O4
b)
nFe=16,8/56=0,3mol
nO2=6,72/22,4=0,3mol
Ta có: 0,3/3<0,3/2=> O2 dư tính theo Fe
nFe3O4=0,3/3=0,1
mFe3O4=0,1.232=23,2g

Zn+2HCl->ZnCl2+H2
0,05--------------------0,05
CuO+H2-to>Cu+H2O
0,05----0,05
n Zn=\(\dfrac{3,25}{65}=0,05mol\)
=>n CuO=\(\dfrac{6}{80}=0,075mol\)
=>CuO dư
=>m Cu=0,05.64=3,2g
=>m CuO dư=0,025.80=2g
\(a,PTHH:\\ Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\left(1\right)\\ CuO+H_2\underrightarrow{t^o}Cu+H_2O\left(2\right)\\ b,n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\\ Theo.pt\left(1\right):n_{H_2}=n_{Zn}=0,05\left(mol\right)\\ n_{CuO}=\dfrac{6}{80}=0,075\left(mol\right)\\ LTL.pt\left(2\right):0,075>0,05\Rightarrow CuO,dư\\ Theo.pt\left(2\right):n_{Cu}=n_{CuO\left(pư\right)}=n_{H_2}=0,05\left(mol\right)\\ m_{Cu}=0,05.64=3,2\left(g\right)\\ c,m_{CuO\left(dư\right)}=\left(0,075-0,05\right).80=2\left(g\right)\)

a)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
b)
Ta có :
\(n_{Fe} = \dfrac{8,4}{56} = 0,15(mol)\\ n_{O_2} = \dfrac{96}{32} = 3(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{3} = 0,05 < \dfrac{n_{O_2}}{2} = 1,5\) do đó O2 dư.
Theo PTHH :
\(n_{O_2\ pư} = \dfrac{2}{3}n_{Fe} = 0,1(mol)\\ \Rightarrow n_{O_2\ dư} = 3 - 0,1 = 2,9(mol)\\ \Rightarrow m_{O_2\ dư} = 92,8(gam)\)
c)
\(n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = 0,05(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,05.232 = 11,6(gam)\)
\(a)PTHH:FeCl_3+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
mol 1 2 1
mol
\(b)\)Số mol \(FeCl_3\) là: \(n_{FeCl_3}=\dfrac{m_{FeCl_3}}{M_{FeCl_3}}=\dfrac{8,4}{162,5}=0,052\left(mol\right)\)
Số mol \(O_2\) là: \(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{96}{32}=3\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{1}{0,052}>\dfrac{2}{3}\Rightarrow FeCl_3dư\)
Số mol \(FeCl_3\) phản ứng là:
Từ PTHH\(\Rightarrow\) \(n_{FeCl_3}=\dfrac{0,052\times3}{3}=0,035\left(mol\right)\)
Số mol \(FeCl_3\) dư là: \(n_{FeCl_3dư}=n_{FeCl_3đầu}-n_{FeCl_3p/ứng}=0,052-0,035=0,018\left(mol\right)\)
Khối lượng \(FeCl_3\) dư là: \(m_{FeCl_3dư}=n_{FeCl_3dư}\times M_{FeCl_3}=0,018\times162,5=2,925\left(g\right)\)

PTHH: \(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\\n_{HCl}=\dfrac{300\cdot3,65\%}{36,5}=0,3\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,3}{8}\) \(\Rightarrow\) Fe3O4 còn dư, HCl p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_3O_4\left(dư\right)}=0,0625\left(mol\right)\\n_{FeCl_2}=0,0375\left(mol\right)\\m_{FeCl_3}=0,075\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_3O_4\left(dư\right)}=0,0625\cdot232=14,5\left(g\right)\\m_{muối}=0,0375\cdot127+0,075\cdot162,5=16,95\left(g\right)\end{matrix}\right.\)
nFe3O4= 23,2/232=0,1(mol); nHCl = (300.3,65%)/36,5= 0,3(mol)
a) PTHH: Fe3O4 + 8 HCl -> 2 FeCl3 + FeCl2 + 4 H2O
b) Ta có: 0,3/8 < 0,1/1
=> Fe3O4 dư, HCl hết, tính theo nHCl.
=> nFe3O4(p.ứ)= nFeCl2= nHCl/8=0,3/8= 0,0375(mol)
=> mFe3O4(dư)= (0,1- 0,0375).232=14,5(g)
c) nFeCl3= 2/8. 0,3= 0,075(mol)
=> mFeCl3= 0,075.162,5=12,1875(g)
mFeCl2= 0,0375. 127=4,7625(g)
=>m(muối)= 12,1875+ 4,7625= 16,95(g)

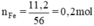
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

Câu 1:
a, Thí nghiệm 1:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Thí nghiệm 2:
\(3H_2+Fe_2O_3\underrightarrow{^{t^o}}2Fe+3H_2O\)
b, Ta có:
\(n_{Mg}=\frac{13,44}{24}=0,56\left(mol\right)\)
\(\Rightarrow n_{H2}=n_{MgSO4}=n_{Mg}=0,56\left(mol\right)\)
\(\Rightarrow V_{H2}=0,56.22,4=12,544\left(l\right)\)
\(\Rightarrow m_{MgSO4}=0,56.120=67,2\left(g\right)\)
c,\(n_{Fe2O3}=\frac{1}{3}n_{H2}=\frac{1}{3}.0,56=\frac{14}{75}\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=\frac{14}{75}.160=\frac{448}{15}\left(g\right)\)
Câu 2:
d,
\(Zn+2HCl\rightarrow ZnCl_2+H_2\left(1\right)\)
\(Fe_3O_4+4H_2\underrightarrow{^{t^o}}3Fe+4H_2O\left(2\right)\)
e, Ta có:
\(n_{H2}=\frac{5,376}{22,4}=0,24\left(mol\right)\)
Theo PTHH1:
\(n_{HCl}=2n_{H2}=0,48\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=17,52\left(g\right)\)
\(n_{ZnCl2}=n_{H2}=0,24\left(mol\right)\)
\(\Rightarrow m_{ZnCl2}=0,24.136=32,64\left(g\right)\)
f, Theo PTHH2:
\(n_{Fe3O4}=\frac{1}{4}n_{H2}=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe3O4}=0,06.232=13,92\left(g\right)\)

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.98=9,8\left(g\right)\)
b, \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

a.b.
\(n_{Na}=\dfrac{13,8}{23}=0,6mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,6 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
c.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,3 ( mol )
0,15 0,15 ( mol )
Chất dư là H2
\(m_{H_2}=\left(0,3-0,15\right).2=0,3g\)
4H2+Fe3O4-to>3Fe+4H2O
nH2=4,48\22,4=0,2 mol
nFe3O4=23,3\232=0,1 mol
=>Fe3O4 du2
=>mFe3O4=0,05 .232=11,6g
=>mH2O=0,2.18=3,6g