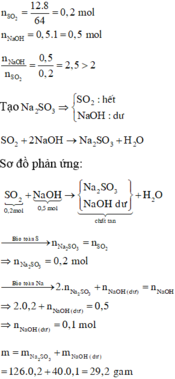
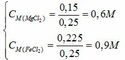Cho 12,8 gam khí SO2 vào 250ml dung dịch NaOH 1M . tính nồng độ mol các chất trong dung dịch thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO 2 (0,1 mol) vậy sản phẩm là muối Na 2 SO 3 . Ta có PTHH :
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
- Khối lượng của dung dịch sau phản ứng :
m dd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
m Na 2 SO 3 = 126.0,1 = 12,6g
m NaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C % Na 2 SO 3 = 12,6/150 x 100% = 8,4%
C % NaOH dư = 4/150 x 100% = 2,67%

Số mol SO2 và NaOH lần lượt là 0,2 và 0,25.
1 < OH-/SO2=1,25 < 2 ⇒ Dung dịch X chứa hai muối Na2SO3 và NaHSO3.
\(n_{Na_2SO_3}=0,25-0,2=0,05\left(mol\right)\) ⇒ \(n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\).
1. Khối lượng muối có trong X:
m=0,05.126+0,15.104=21,9 (g).
2. Nồng độ mol/l các chất trong X:
\(C_{M\left(Na_2SO_3\right)}\)=0,05/0,2=0,25 (mol/l).
\(C_{M\left(NaHSO_3\right)}\)=0,15/0,2=0,75 (mol/l).
3. Khối lượng kết tủa BaSO3 là:
m'=0,2.217=43,4 (g).

a, \(n_{HNO_3}=0,3.1=0,3\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,1.1=0,1\left(mol\right)\)
PT: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,1}{1}\), ta được HNO3 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{Ba\left(NO_3\right)_2}=n_{Ba\left(OH\right)_2}=0,1\left(mol\right)\\n_{HNO_3\left(pư\right)}=2n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ nHNO3 (dư) = 0,3 - 0,2 = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Ba\left(NO_3\right)_2}}=\dfrac{0,1}{0,3+0,1}=0,25\left(M\right)\\C_{M_{HNO_3\left(dư\right)}}=\dfrac{0,1}{0,3+0,1}=0,25\left(M\right)\end{matrix}\right.\)
b, Ta có: \(n_{Na_2CO_3}=0,25.0,5=0,125\left(mol\right)\)
PT: \(Na_2CO_3+2HNO_3\rightarrow2NaNO_3+CO_2+H_2O\)
______0,05______0,1_______________0,05 (mol)
⇒ VCO2 = 0,05.22,4 = 1,12 (l)
\(Na_2CO_3+Ba\left(NO_3\right)_2\rightarrow2NaNO_3+BaCO_{3\downarrow}\)
0,075________0,075_______________0,075 (mol)
⇒ mBaCO3 = 0,075.197 = 14,775 (g)

\(1,n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ n_{NaOH}=1.0,3=0,3\left(mol\right)\)
\(T=\dfrac{0,3}{0,4}=0,75\rightarrow\)Tạo muối axit (NaHSO3) và SO2 dư
PTHH: NaOH + SO2 ---> NaHSO3
0,3------------------->0,3
\(C_{M\left(NaHSO_3\right)}=\dfrac{0,3}{0,3}=1M\)
\(2,n_{H_2S}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{NaOH}=0,2.2=0,4\left(mol\right)\)
\(T=\dfrac{0,4}{0,3}=\dfrac{4}{3}\rightarrow\)Tạo cả 2 muối (NaHS và Na2S)
PTHH:
2NaOH + H2S ---> Na2S + 2H2O
0,4--------->0,2------>0,2
Na2S + H2S ---> 2NaHS
0,1<------0,1------->0,2
\(\rightarrow\left\{{}\begin{matrix}C_{M\left(Na_2S\right)}=\dfrac{0,2-0,1}{0,2}=0,5M\\C_{M\left(NaHS\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
1/ Số mol khí SO2 và NaOH lần lượt là 8,96:22,4=0,4 (mol) và 0,3.1=0,3 (mol). n\(OH^-\)/n\(SO_2\)=0,75<1, suy ra dung dịch thu được chỉ có muối NaHSO3 (0,3 mol).
Nồng độ mol cần tìm là CM \(\left(NaHSO_3\right)\)=0,3/0,3=1 (mol/l).
2/ Số mol khí H2S và NaOH là 6,72:22,4=0,3 (mol) và 0,2.2=0,4 (mol). n\(OH^-\)/n\(H_2S\)=4/3<2, suy ra dung dịch thu được chỉ có muối Na2S (0,2 mol).
Nồng độ mol cần tìm là CM \(\left(Na_2S\right)\)=0,2/0,2=1 (mol/l).

nMg = 3,6/24 = 0,15 mol; nFeCl3 = 0,25.1 = 0,25 mol
Mg + 2FeCl3 → MgCl2 + 2FeCl2
0,125dư 0,025←0,25 → 0,125 → 0,25 (mol)
Mg + FeCl2 → MgCl2 + Fe
0,025→0,025 →0,025→0,025 (mol)
Vậy chất rắn sau phản ứng là Fe: nFe = 0,025 mol
=> m = mFe = 0,025.56 = 1,4 (gam)
Dung dịch X sau phản ứng gồm:
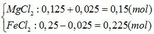
Nồng độ của các chất trong dung dịch X: