Khử một oxit sắt chưa rõ hóa trị bằng khí H2 dư nung nóng sản phẩm hơi tạo ra hấp thụ 94,6 g dung dịch H2SO4 51,8% thì C% dung dịch giảm 3,67%. Mặt khác, chất rắn sau Phản Ứng Hòa tan bằng dung dịch H2SO4 loãng thấy thoát ra 6,72l H2 (dktc). Tính CTPT của oxit sắt ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi n H2O = a(mol)
m H2SO4 = 500.98% = 490(gam)
Ta có :
C% H2SO4 = 490/(500 + 18a) .100% = 98% - 7,794%
=> a = 2,4
$H_2 + O_{oxit} \to H_2O$
n O(oxit) = n H2O = 2,4(mol)
Chất rắn thu được là Fe
$Fe + 2HCl \to FeCl_2 + H_2$
n Fe = n H2 = 40,32/22,4 = 1,8(gam)
Ta có :
n Fe / n O = 1,8/2,4 = 3/4
Vậy CTHH của oxit là Fe3O4

Trong 100g H2SO4 98% có 98g H2SO4
Sau khi hấp thụ 18x gam nước, khối lượng dd là 100+18x gam; C%= 98-3,405= 94,595%
=> 98.100100+18x98.100100+18x= 94,595
=> x= 0,2 mol= nH2O
H2+ O -> H2O
=> nO= nH2O= 0,2 mol
nH2= 3,3622,43,3622,4= 0,15 mol
Fe+ H2SO4 -> FeSO4+ H2
=> nFe= 0,15 mol
nFe: nO= 0,15: 0,2= 3:4
Vậy oxit là Fe3O4

yH2 + FexOy -to-> xFe +yH2O (1)
Fe +2HCl --> FeCl2 +H2(2)
mH2SO4=49(g)
=>mdd sau pư=\(\dfrac{49.100}{98-5,021}=52,7\left(g\right)\)
=>mH2O=52,7-50=2,7(g)=>nH2O=0,15(mol)
nH2(2)=0,1(mol)
theo (2) : nFe=nH2(2)=0,1(Mol)
theo (1) : nFe=x/ynH2O
=> 0,1.x/y=0,15=> x/y=2/3
=>CTHH :Fe2O3

mH2SO4=98g
C%=98%-3,405%=94,595%
=>mdd sau=mH2SO4/0,94595=103,6g
=>mH2O=103,6-100=3,6
=>nH2O=0,2
=>nO trog oxit=nH2O =0,2
(giai thich: cu 1 mol H2 pu thi lay di 1 mol O trog oxit)
nFe=nH2=0,15
=>nFe:nO=0,15:0,2=3:4
=>Fe3O4.

mH2So4=50*98/100=49;mH2O=[4900-(98-5,012)*50]/(98-5.012)=2.7;nH2O=0,15;nFe=nH2=2.24/22.4=0,1**** Pthh: 1.FexOy+yH2=>xFe+yH2O ;2.Fe+2HCl=>FeCl2+H2 ****** T a có , x:y=0,1:0.15=2:3 =>CTHH:Fe2O3



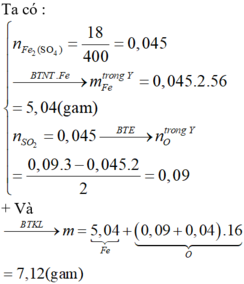
Xem lại đề !