Dung dịch A chứa 0,1 mol Na + và 0,3 mol Ba 2+ và c mol Cl –
a, tính c = ?
b, trộn 200ml dd Na2SO4 1M vào dung dịch A. Tính khối lượng kết tủa thu được.
( Mấy cái như Na + là Na mũ 1+, Ba 2+ là Ba mũ 2+,...)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n H + = 2 n H 2 S O 4 = 0 , 15 . 2 = 0 , 3 ; n S O 4 2 - = 0 , 15 v à n C O 3 2 - = 0 , 1 ; n H C O 3 - = 0 , 3
Xác định tỉ lệ số mol của C O 3 2 - v à H C O 3 - và trong dung dịch ta có:
n N a 2 C O 3 n N a H C O 3 = 0 , 1 0 , 3 = 1 3
So sánh số mol: Ta có: ( 2 n C O 3 2 - + n H C O 3 2 - ) = 0 , 5 > n H + = 0 , 3 ⇒ H + h ế t
Khi cho từ từ A vào B nên C O 3 2 - và H C O 3 - sẽ đồng thời phản ứng với axit.
Vì vậy giả sử nếu C O 3 2 - phản ứng hết x mol thì H C O 3 - sẽ phản ứng 1 lượng đúng bằng tỉ lệ mol trong dung dịch của 2 chất là 3x mol.
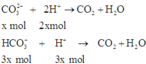
Do H+ hết nên tính theo H+ ta có: 5x = 0,3 ⇒ x = 0,6
⇒ Trong X chứa anion: H C O 3 - (0,3 – 3.0,6 = 0,12 mol), C O 3 2 - (0,1 – 0,06 = 0,04 mol) và S O 4 2 - (0,15 mol)
Khi cho Ba(OH)2 dư vào ta có các phản ứng:
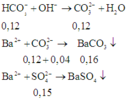
Vậy khối lượng kết tủa thu được là:
![]()

Đáp án A
Theo ĐLBT ĐT có: dung dịch chứa Ba2+ 0,02 mol, OH- 0,06 mol và Na+ 0,02 mol với dung dịch chứa HCO3- 0,04 mol ; CO32- 0,03 mol và Na+ 0,1 mol
HCO3-+ OH-→ CO32-+ H2O
0,04 0,06 0,04 mol
Ba2++ CO32-→ BaCO3
0,02 0,07 0,02 mol
suy ra mBaCO3 = 0,02.197 = 3,94 gam

\(HCO_3^-+OH^-\rightarrow CO_3^{2-}+H_2O\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\downarrow\)
\(n_{Ba^{2+}}=0,15+0,1=0,25\left(mol\right)\)
\(n_{HCO_3^-}=0,2\left(mol\right)\)
\(n_{OH^-}=0,2\left(mol\right)\)
\(\Rightarrow n_{CO_3^{2-}}=0,2\left(mol\right)\)
\(\Rightarrow n_{BaCO_3\downarrow}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaCO_3\downarrow}=0,2.197=39,4\left(g\right)\)

Đáp án B
Bảo toàn điện tích → nNH4+= 0,25 mol
Khi cho 0,54 mol Ba(OH)2 vào dung dịch X xảy ra các phương trình sau:
NH4+ + OH- → NH3↑ + H2O (1)
Ba2+ + CO32- → BaCO3↓ (2)
Khối lượng dung dịch giảm = mNH3 + mBaCO3 = 0,108×17 + 0,025× 197= 6,761 gam.
Đáp án B
Chú ý trong (1) : nOH- < nNH4+ nên nNH3 = nNH4+ = 0,108 mol
Trong (2) thì nBa2+ > nCO32- → nBaCO3 = nCO32-
Áp dụng định luật bảo toàn điện tích
=> nNa+.1 + nBa2+.2 = nCl-.1
Thay số tính ra c nha em.
nNa2SO4 = 0,2 mol
Na2SO4 → 2Na+ + SO42-
=> nSO42- = 0,2 mol
Ba2+ + SO42- → BaSO4↓
0,3____0,2 (mol)
0,2<----0,2----------> 0,2 (mol)
0,1____0_________0,2 (mol)
=>mkết tủa = mBaSO4 = 0,2*(137+96)=