so sánh lượng khí sinh ra khi cho cùng 1 lượng Fe lần lượt tác dụng hết với axit sunfuric loãng, dư và axit sunfuric đặc nóng, dư (tạo sản phẩm khử duy nhất là SO2)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{dd.H_2SO_4}=51,5.1,84=94,76\left(g\right)\)
\(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,2<----0,6<--------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
=> \(n_{Fe_2O_3}=\dfrac{21,4-5,4}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
0,1--->0,3
=> \(m_{H_2SO_4\left(lý.thuyết\right)}=\left(0,6+0,3\right).98=88,2\left(g\right)\)
=> \(m_{H_2SO_4\left(tt\right)}=88,2.105\%=92,61\left(g\right)\)
=> \(C\%=\dfrac{92,61}{94,76}.100\%=97,7\%\)

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
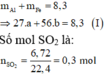
Sơ đồ phản ứng:
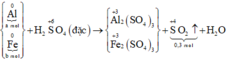
Các quá trình nhường, nhận electron:


Chọn C
C a C O 3 + H 2 S O 4 ( l o ã n g ) → C a S O 4 + C O 2 + H 2 O
C a C O 3 + H 2 S O 4 ( đ ặ c ) → C a S O 4 + C O 2 + H 2 O

Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`

\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2
a------------------------------>a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}56a+65b=2,14\\a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,015\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
2Fe + 6H2SO4(đ, n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,015--------------------------------------->0,0225
Zn + 2H2SO4(đ, n) ---> ZnSO4 + SO2 + 2H2O
0,02---------------------------------->0,02
=> VSO2 = (0,0225 + 0,02).22,4 = 0,952 (l)


- 1 lượng Fe lần lượt tác dụng hết với axit sunfuric loãng, dư và axit sunfuric đặc nóng, dư
Fe + H2SO4 => FeSO4 + H2
1___________1_____________
2Fe + 6H2SO4 => Fe2(SO4)3 + 3SO2 + 6H2O
1_______________1,5________________
=> nH2 < nSO2
Nên lượng khí sinh ra khi cho Fe tác dụng với H2SO4 đặc nóng lớn hơn khi cho Fe tác dụng vs H2SO4 loãng