Để điều chế được 1700g NH3 thì phải dùng một lượng N2 và H2 là bao nhiêu biết hiệu suất phản ứng là 25%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có:
\(n_{NH3}=\frac{1700}{17}=100\left(mol\right)\)
\(PTHH:N_2+3H_2\underrightarrow{^{t^o}}2NH_3\)
________50 ____150 __ 100____
\(n_{N2}=\frac{50}{H}=\frac{50}{25\%}=200\left(mol\right)\)
\(\Rightarrow m_{N2}=200.28=5600\left(g\right)\)
\(n_{H2}=\frac{150}{H}=\frac{150}{25\%}=600\left(mol\right)\Rightarrow m_{H2}=600.2=1200\left(g\right)\)
Vậy cần dùng 5600g N2 và 1200g H2

Vì hiệu suất là 25%
=> \(m_{NH_3}=17.\dfrac{25\%}{100\%}=4,25\left(g\right)\)
Ta có: \(n_{NH_3}=\dfrac{4,25}{17}=0,25\left(mol\right)\)
PTHH: N2 + 3H2 ---> 2NH3
Theo PT: \(n_{H_2}=\dfrac{3}{2}.n_{NH_3}=\dfrac{3}{2}.0,25=0,375\left(mol\right)\)
=> \(V_{H_2}=0,375.22,4=8,4\left(lít\right)\)
Theo PT: \(n_{N_2}=\dfrac{1}{2}.n_{NH_3}=\dfrac{1}{2}.0,25=0,125\left(mol\right)\)
=> \(V_{N_2}=0,125.22,4=2,8\left(lít\right)\)
\(n_{NH_3}=1\left(mol\right)\)
Bảo toàn nguyên tố:
\(\left\{{}\begin{matrix}n_{N_2}=\dfrac{n_{NH_3}}{2}=0,5\left(mol\right)\\n_{H_2}=\dfrac{3n_{NH_3}}{2}=1,5\left(mol\right)\end{matrix}\right.\)
Do hiệu suất 25% \(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=6\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_{N_2}=44,8\left(l\right)\\n_{H_2}=134,4\left(l\right)\end{matrix}\right.\)

PTHH:3H2+N2=2NH3
nNH3=0,2(mol) suy ra nH2=0,3(mol);nN2=0,1(mol)
suy ra V H2=6,72(l);V N2=2,24(l)
mà hiệu suất phản ứng chỉ có 20 phần trăm
suy ra V H2 cần dùng để điều chế 4,48 lít NH3 là:6,72x100:20=3,36(l)
V N2 cần dùng để điều chế 4,48 lít NH3 là:2,24x100:20=11,2(l)

$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$

- Đáp án A
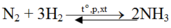
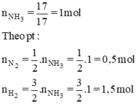
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).

Đáp án D
N2 + 3H2![]() 2NH3
2NH3
Theo PT VH2=3/2VNH3= 6 lít
Do hiệu suất 50% nên:
VH2 thực tế= 100. VH2/50= 100.6/50= 12 lít
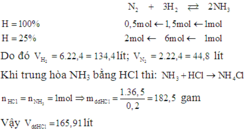
\(n_{NH3}=\frac{1700}{17}=100\left(mol\right)\)
PTHH:
\(N_2+3H_2->2NH3\)
(mol) 50 150 100
Theo PTHH:
\(\left\{{}\begin{matrix}n_{H2pư}=\frac{3}{2}\cdot n_{NH3}=\frac{3}{2}\cdot100=150\left(mol\right)\\n_{N2pư}=\frac{1}{2}\cdot n_{NH3}=\frac{1}{2}\cdot100=50\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}n_{H2pư}=150\cdot2=300\left(g\right)\\n_{N2pư}=50\cdot28=1400\left(g\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}n_{H2}=300\cdot\frac{100}{25}=1200\left(g\right)\\n_{N2}=1400\cdot\frac{100}{25}=5600\left(g\right)\end{matrix}\right.\)
Vậy ...
nNH3=1700/17=100mol
PTHH: NN+3H2->2NH3
100/2<-100.3/2<-100
Theo pthh có nN2 =50 mol
mN2( cần dùng )=50.28.100/25=5600g
Theo pthh nH2= 150mol
mH2(cần dùng)=150.2.100/25=1200g