Dùng CO dư để khử hoàn toàn m g bột sắt oxit(FexOy) thành sắt, dẫn toàn bộ lượng khí sinh ra đi thật chậm qua 1 lít dd Ba(OH)2 0.1 M thì phản ứng vừ đủ và thu được 9.85 g kết tủa. Mặt khác hòa tan toàn bộ sắt kim loại thu được ở trên bằng dd HCl dư rồi cô cạn thì thu được 12.7 g muối khan . công thức sắt oxit(FexOy)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức oxit là FexOy
Ta có : FexOy + xCO \(\underrightarrow{t0}\) xFe + yCO2
Theo đề ta có : \(\left\{{}\begin{matrix}nBa\left(OH\right)=0,1.1=0,1\left(mol\right)\\nBaCO3=\dfrac{9,85}{197}=0,05\left(mol\right)\end{matrix}\right.\)
Ta có PTHH :
Ba(OH)2 + CO2 \(\rightarrow\) BaCO3 \(\downarrow\) + H2O
0,1mol...........0,1mol.....0,1mol
Vì Số mol của BaCO3 còn nên ta có PT :
BaCO3 + H2O + CO2 \(\rightarrow\) Ba(HCO3)2
0,05mol...............0,05mol....0,05mol
=> nCO2 = 0,1+ 0,05 = 0,15 (mol)
Ta có : nCO2 = nO(trong oxit sắt) = 0,15 (mol)
Mặt khác hòa tan tòan bộ m gam bột sắt oxit trên bằng dd HCl dư
FexOy + 2y HCl \(\rightarrow\) x FeCl2y/x + y H2O
thì có sự trao đổi giữa O(trong oxit) vs Cl( trong muối) hay O(-2) với Cl(-)
=> nCl = 2
=> nCl = 2.nO = 2.0,15 = 0,3 (mol)
Theo bảo toàn nguyên tố Cl ta có :
mFe = mFeCl - mCl = 16,25 - 10,65 = 5,6 (g)
=> nFe = \(\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có : \(\dfrac{nFe}{nO}=\dfrac{x}{y}=\dfrac{0,1}{0,15}=\dfrac{2}{3}\) => x = 2 ; y= 3
=> CTHH của oxit sắt là Fe2O3
Ta có : nFe2O3 = 1/3nCO2 = 1/3.0,15 = 0,05 (mol)
=> mFe2O3 = 0,05.160 = 8 (g)
Vậy...............

\(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\) \(\Rightarrow y=0,03\left(mol\right)\)
\(Fe_xO_y+yH_2\rightarrow\left(t^o\right)xFe+yH_2O\)
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,02 0,02 ( mol )
\(\Rightarrow x=0,02\left(mol\right)\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,02}{0,03}=\dfrac{2}{3}\)
\(\Rightarrow CTHH:Fe_2O_3\)
\(n_{H_2\left(thu\right)}=\dfrac{V}{22,4}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
1 : 1 (mol)
0,02 : 0,02 (mol)
\(n_{H_2\left(dùng\right)}=\dfrac{V}{22,4}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
\(yH_2+Fe_xO_y\rightarrow^{t^0}xFe+yH_2O\)
y : x (mol)
0,03 : 0,02 (mol)
\(\Rightarrow\dfrac{0,03}{y}=\dfrac{0,02}{x}\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,02}{0,03}=\dfrac{2}{3}\Rightarrow x=2;y=3\)
-Vậy CTHH của oxit sắt là Fe2O3.

số oxh của Fe cả quá trình k đổi..bảo toàn e =>nCaC03=nC02=n0=n02/2=0,05 mol

a) nCaCO3 = 0.3 (mol)
CO + O => CO2
=> nO = 0.3 (mol)
mFe = moxit - mO = 16 - 0.3*16 = 11.2 (g)
nFe = 11.2/56 = 0.2 (mol)
nFe : nO = 0.2 : 0.3 = 2 : 3
CT oxit : Fe2O3

n(H2)=1,68/22=0,075m0l
n(CaC03)=10/1O0=0,1m0l
gọi công thức oxit sát là FexOy
Ptpu:
Fex0y + yCO ===> xFe + yC02 (1)
Fe + 2HCL ===> FeCl2 + H2
0,075m0l <-----. . . . . . . . . . ---- 0,075m0l
C02 + Ca(0H)2 ===> CaC03 + H20
0,1m0l <-----. . . . . . . . . . 0,1m0l
Theo tỉ lệ số mol theo phương trình (1) ta co:
x/y=n(Fe)/n(C02)=0,075/0,1=3/4
Vay oxit sat can tim la oxit sat tu Fe304
Than yC02
0,15/x(m0l) <=== 0,15
Theobài thì khối lượng oxit sắt oh 2 p/u = nhau nên số mol = nhau hay (0,225/y)=(0,15/x)
<=>0,225x=0,15y
<=>x=2y/3
<=>x/y=2/3
Vậy oxit có công thức là Fe203



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

`a)`
Oxit: `Fe_xO_y`
`Fe_xO_y+yCO` $\xrightarrow{t^o}$ `xFe+yCO_2`
`CO_2+Ca(OH)_2->CaCO_3+H_2O`
Theo PT: `n_{CO_2}=n_{CaCO_3}=7/{100}=0,07(mol)`
`->n_{Fe_xO_y}={n_{CO_2}}/y={0,07}/y(mol)`
`->M_{Fe_xO_y}={4,06}/{{0,07}/y}=58y`
`->56x+16y=58y`
`->x/y={42}/{56}=3/4`
`->` Oxit: `Fe_3O_4`
`b)`
`n_{Fe_3O_4}={4,06}/{232}=0,0175(mol)`
`2Fe_3O_4+10H_2SO_4->3Fe_2(SO_4)_3+SO_2+10H_2O`
Đề thiếu.
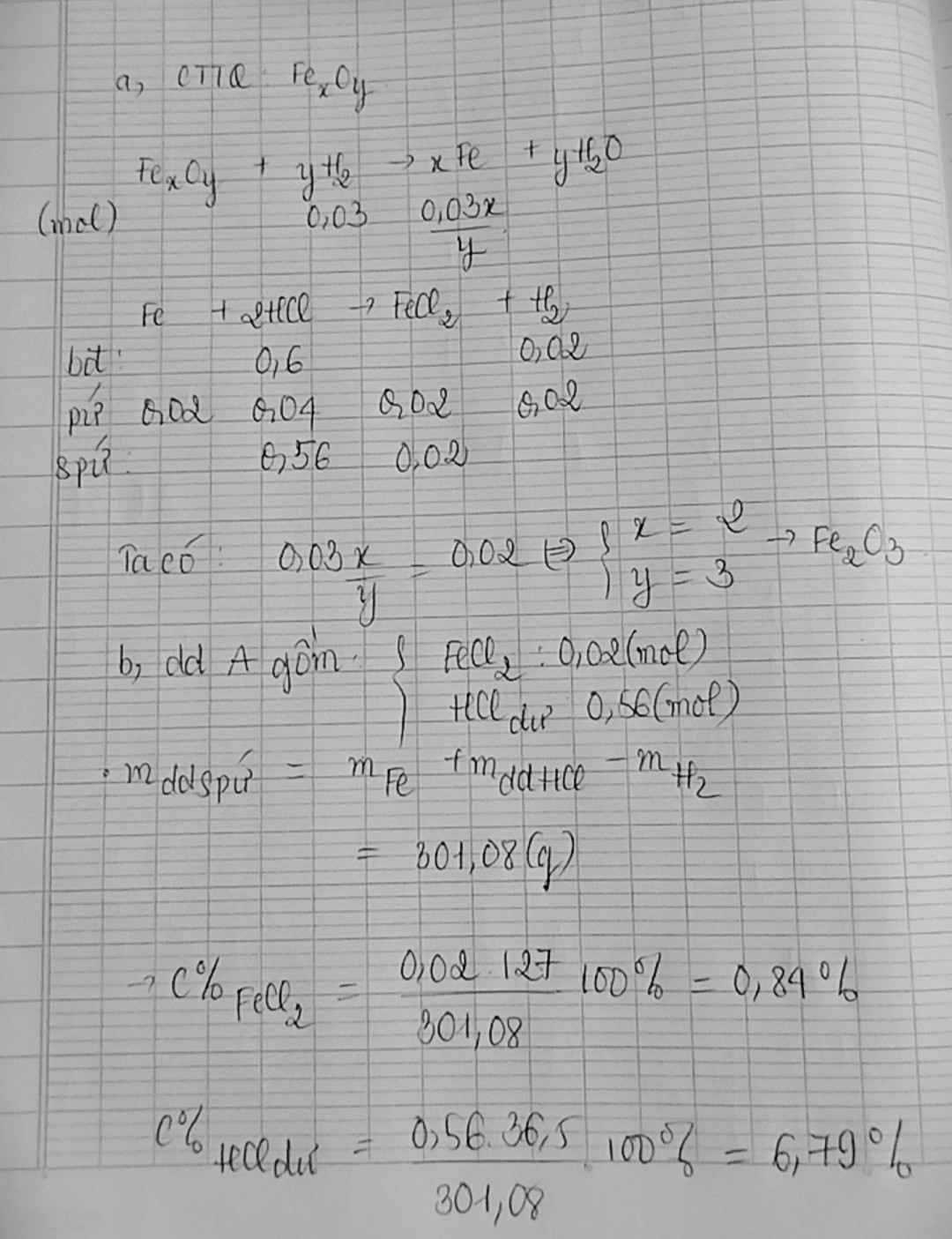

Bài này copy của bạn buithianhtho ở câu hỏi khác. Xin phép xóa
Từ dữ kiện số mol Ba(OH)2 và BaCO3 chưa đủ để kết luận Co2 dư đâu nha em
\n