cho bột Al dư tác dụng với dung dịch chứa 0,25 mol H2SO4 sau khi phản ứng hoàn toàn thoát ra V lít khí H2(đktc)
1, Tính V?
2, Dẫn từ từ lượng khí thu được ở trên qua cốc sứ có chứa 21,6 gam FeO nung nóng, sau thí nghiệm khối lượng chất rắn còn lại trong ống là 18,4 gam. Hãy tính hiệu suất của phản ứng khử FeO



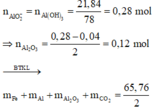
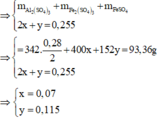
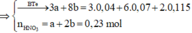
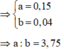

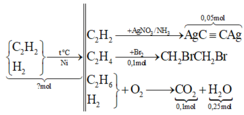
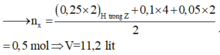

1/ 2Al + 3H2SO4 --------> Al2(SO4)3 + 3H2
Theo PT : \(n_{H_2}=\frac{3}{2}n_{H_2SO_4}=0,375\left(mol\right)\)
=> V H2 = 0,375 .22,4 = 8,4( l)
2/\(n_{FeO}=\frac{21,6}{72}=0,3\left(mol\right)\)
PTHH: \(FeO+H_2-^{t^o}\rightarrow Fe+H_2O\)
Lập tỉ lệ FeO và H2 : \(\frac{0,3}{1}< \frac{0,375}{1}\)=> Sau phản ứng H2 dư
Theo PT: nFe = n FeO=0,3(mol)
\(\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
Mà theo đề chất rắn còn lại trong ống là 18,4 (g)
=> FeO không phản ứng hết
=> m FeO dư = 18,4 -16,8 =1,6 (g)
=> m FeO phản ứng = 21,6 -1,6 =20 (g)
\(\Rightarrow H_{FeO}=\frac{20}{21,6}.100=92,593\%\)