Hàm lượng lưu huỳnh trong một mẫu dầu hỏa được xác định bằng cách đốt 4,476g mẫu trong lò. Sản phẩm đốt được đem dẫn vào dung dịch H2O2 3%. Khí SO2 cho PỨ: SO2 + H2O2 -> H2SO4. Người ta thêm vào phản ứng 25 ml dd NaOH 0,00923 M. Lượng NaOH dư đã PỨ hết với 13,33 ml dd HCl 0,01007 M. Tính % Lưu huỳnh trong mẫu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án
Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,3% theo khối lượng. Để xác minh hàm lượng lưu huỳnh trong một loại nhiên liệu, người ta lấy nhiên liệu đem nghiền nhỉ gọi là hiện tượng vật lý, rồi đem đốt cháy hoàn toàn thu được hỗn hợp khí gồm cacbon dioxit, lưu huỳnh dioxit. Sau đó, dẫn khí vào dung dịch nước vôi trong thấy tạo kết tủa trắng gọi là hiện tượng hóa học

PTHH : \(S+O_2\left(t^o\right)->SO_2\) (1)
\(SO_2+H_2O->H_2SO_3\) (2)
\(n_{SO_2}=\dfrac{V_{đktc}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Từ (1) -> \(n_S=n_{SO_2}=0,05\left(mol\right)\)
-> \(m_S=n.M=1,6\left(g\right)\)
Từ (2) -> \(n_{H_2SO_3}=n_{SO_2}=0,05\left(mol\right)\)
-> \(m_{H_2SO_3}=n.M=0,05.\left(2+32+16.3\right)=4,1\left(g\right)\)

Câu 11:
\(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\)
Ban đầu: 0,2 0,4 0,2
Sau pư: 0 0,2 0,2
`=>`\(\left\{{}\begin{matrix}m_{H_2SO_4}=0,2.98=19,6\left(g\right)\\m_{CaSO_4}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
Câu 12:
\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right);n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: \(S+O_2\xrightarrow[]{t^o}SO_2\)
Ban đầu: 0,2 0,5
Sau pư: 0 0,3 0,2
`=>`\(\left\{{}\begin{matrix}V_{O_2}=0,3.22,4=6,72\left(l\right)\\V_{SO_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
Câu 13:
\(n_C=\dfrac{4,8}{12}=0,4\left(mol\right);n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Ban đầu: 0,4 0,3
Sau pư: 0,1 0 0,3
`=>`\(\left\{{}\begin{matrix}m_{C\left(d\text{ư}\right)}=0,1.12=1,2\left(g\right)\\V_{CO_2}=0,3.22,4=6,72\left(l\right)\end{matrix}\right.\)
Câu 14:
\(n_{BaCl_2}=\dfrac{20,8}{208}=0,1\left(mol\right);n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Ban đầu: 0,1 0,1
Sau pư: 0 0 0,1 0,2
`=>`\(\left\{{}\begin{matrix}m_{BaSO_4}=0,1.233=23,3\left(g\right)\\m_{HCl}=0,2.36,5=7,3\left(g\right)\end{matrix}\right.\)
Câu 15:
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Ban đầu: 0,25 0,5
Sau pư: 0 0 0,25
`=>`\(m_{CuCl_2}=0,25.135=33,75\left(g\right)\)

Khi đốt mẫu gang trong oxi, cacbon cháy tạo thành C O 2 . Dẫn C O 2 qua nước vôi trong dư, toàn bộ lượng C O 2 chuyển thành kết tủa C a C O 3 .
C + O 2 → t ° C O 2 (1)
C O 2 + C a ( O H ) 2 → C a C O 3 ↑ + H 2 O (2)
Theo các phản ứng (1) và (2): n c = n C O 2 = n C a C O 3 = 0,01 (mol)
Khối lượng cacbon: m C = 0,01.12 = 0,12 (g)
Hàm lượng (%) cacbon trong mẫu gang:
%C = 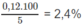

nS =nSO2=0,2 mol
mS= 6,4 gam
độ tinh khiết = 6,4/6,8=94,12%

Đáp án D
Gọi n(Fe) = a và n(C) = b → 56a + 12b = 99,2
BT e: 3a + 4b =2n(SO2) → n(SO2) = 1,5a + 2b
→ n(hh khí) = 1,5a + 2b + b = 1,5a + 3b = 2,925
→ a = 1,75 và b = 0,1 → % = 0,1. 12. 100% : 99,2 = 1,21%

Đáp án D
Gọi n(Fe) = a và n(C) = b → 56a + 12b = 99,2
BT e: 3a + 4b =2n(SO2) → n(SO2) = 1,5a + 2b
→ n(hh khí) = 1,5a + 2b + b = 1,5a + 3b = 2,925
→ a = 1,75 và b = 0,1 → % = 0,1. 12. 100% : 99,2 = 1,21%
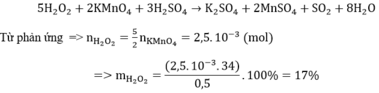
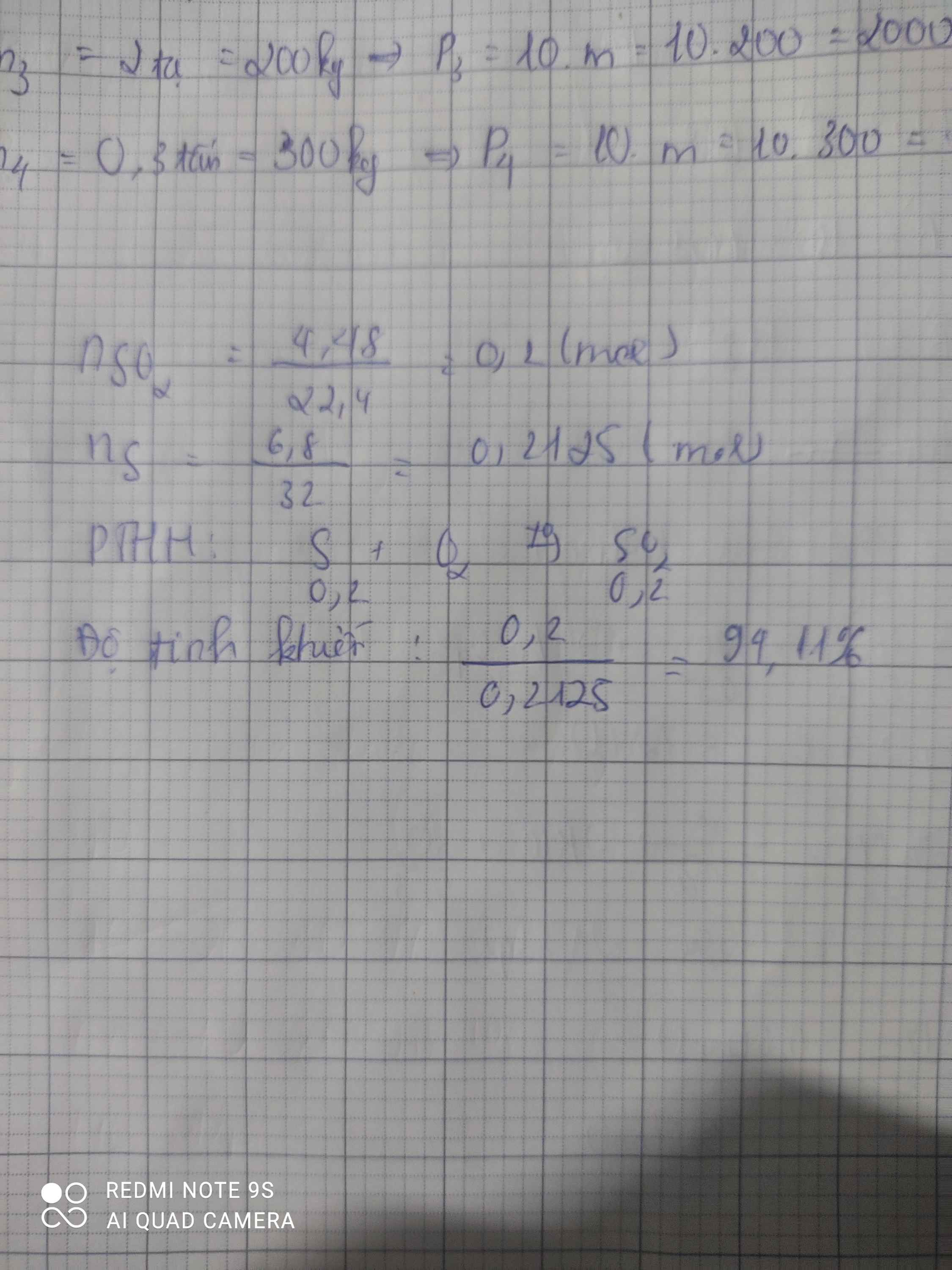
Tks ban rat nhieu!
Ta có:
\(n_{HCl}=0,01333.0,01007=1,342.10^{-4}\left(mol\right)=n_{NaOH\left(dư\right)}\)
\(n_{NaOH}=0,025.0,00923=2,3.10^{-4}\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(Pư\right)}=9,58.10^{-5}\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(\Rightarrow n_{H2SO4}=4,79.10^{-5}\left(mol\right)\)
\(S+O_2\underrightarrow{^{t^o}}SO_2\)
\(SO_2+H_2O_2\rightarrow H_2SO_4\)
\(\Rightarrow n_S=n_{H2SO4}\Rightarrow m_S=1,5328.10^{-3}\left(g\right)\)
\(\Rightarrow\%m_S=\frac{1,5328.10^{-3}}{4,476}.100\%=0,03\%\)