Cho 18,96g KMnO4 vào dung dịch HCl đặc, khí Cl2 thoát ra cho tác dụng hết với kim loại M thu được 53,8g hỗn hợp chất rắn X. Cho X vài dung dịch AgNO3 dư thu được 129,3g. Tìm kim loại M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
► Bảo toàn nguyên tố Clo: nMCl = nAgCl – nHCl = 0,52 – 0,5 = 0,02 mol.
► Nung X chỉ có MHCO3 bị phân hủy: 2MHCO3 → t ° M2CO3 + CO2↑ + H2O.
Khối lượng giảm do thay 2HCO3– ⇄ 1CO32– ||⇒ nMHCO3 = 2 × 20 , 29 - 18 , 74 2 × 61 - 60 = 0,05 mol.
► Bảo toàn nguyên tố C: nM2CO3 = nCO2 – nMHCO3 = 0,15 – 0,05 = 0,1 mol.
⇒ mX = 0,1 × (2M + 60) + 0,05 × (M + 61) + 0,02 × (M + 35,5) = 20,29(g)
⇒ M = 39 ⇒ M là Kali (K)

Đáp án C
2MHCO3 → t 0 M2CO3 + CO2 + H2O
x →0,5x →0,5x
mrắngiảm = mCO2 + mH2O
=> (20,29 – 18,74) = 44. 0,5x + 0,5.18
=> x = 0,05 (mol)
Chất rắn thu được gồm: M2CO3 và MCl
nHCl = 0,5 (mol); nCO2 = 3,36 :22,4 = 0,15 (mol) nAgCl = 74,62:143,5 = 0,52 (mol)
BTNT Cl => nMCl = nAgCl - nHCl = 0,52 – 0,5 = 0,02 (mol)
BTNT C => nM2CO3 = nCO2 – nMHCO3 = 0,15 – 0,05 = 0,1 (mol)
BTKL mX = 0,1( 2M + 60) + 0,05( M + 61) + 0,02 ( M + 35,5) = 20,29 (g)
=> M = 39 (K)
Đáp án C
Chú ý:
Muối của kim loại kiềm M2CO3 sẽ không bị nhiệt phân

Đáp án D
- Khi nung hỗn hợp X thì:

=0,05 mol
- Khi cho hỗn hợp X tác dụng với HCl thì:
![]()
- Khi cho dung dịch Y tác dụng với dung dịch AgNO3 dư thì:
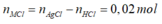
![]()
=> 0,1(2M+60)+0,05(M+61)+0,02(M+35,5) =20,29
=> M = 39. Vậy M là K

Đáp án C
đọc quá trình và phân tích:
• 74,62 gam kết tủa rõ là 0,52 mol AgCl; mà nHCl = 0,5 mol ||→ nMCl = 0,02 mol (theo bảo toàn Cl).
• 20,29 gam X → 18,74 gam chất rắn, giảm là chỉ do phản ứng nhiệt phân muối MHCO3 theo phản ứng:
2MHCO3 → M2CO3 + CO2 + H2O ||→ nMHCO3 = 2 × (20,29 – 18,74) ÷ 62 = 0,05 mol.
• 3,36 lít khí ⇄ 0,15 mol CO2 ||→ theo bảo toàn C có nM2CO3 = 0,1 mol.
||→ 0,1 × (2M + 60) + 0,05 × (M + 61) + 0,02 × (M + 35,5) = 20,29 gam ||→ M = 39 → M là Kali.

Đáp án C
đọc quá trình và phân tích:
• 74,62 gam kết tủa rõ là 0,52 mol AgCl; mà nHCl = 0,5 mol ||→ nMCl = 0,02 mol (theo bảo toàn Cl).
• 20,29 gam X → 18,74 gam chất rắn, giảm là chỉ do phản ứng nhiệt phân muối MHCO3 theo phản ứng:
2MHCO3 → M2CO3 + CO2 + H2O ||→ nMHCO3 = 2 × (20,29 – 18,74) ÷ 62 = 0,05 mol.
• 3,36 lít khí ⇄ 0,15 mol CO2 ||→ theo bảo toàn C có nM2CO3 = 0,1 mol.
||→ 0,1 × (2M + 60) + 0,05 × (M + 61) + 0,02 × (M + 35,5) = 20,29 gam ||→ M = 39 → M là Kali.
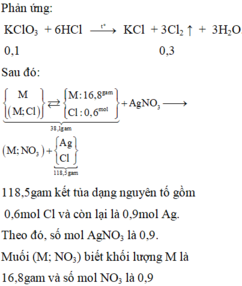
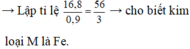
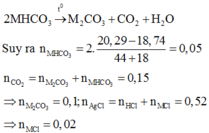
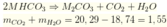

\(n_{KMnO4}=0,12\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2MnCl_2+2KCl+5Cl_2+8H_2O\)
\(\Rightarrow n_{Cl2}=0,3\left(mol\right)\)
X gồm kim loại dư và muối
Kết tủa sau khi cho vào AgNO3 là Ag, AgCl
\(n_{Cl}=0,6\left(mol\right)=n_{AgCl}\)
\(\Rightarrow m_{AgCl}=86,1\left(g\right)\)
\(m_{Ag}=129,3-86,1=43,2\left(g\right)\)
\(\Rightarrow n_{Ag}=0,4\left(mol\right)\)
\(M+nAgNO_3\rightarrow M\left(NO_3\right)_n+nAg\)
\(\Rightarrow n_{M\left(dư\right)}=\frac{0,4}{n}\left(mol\right)\)
\(n_{MCln}=\frac{0,6}{n}\left(mol\right)\)
\(\Rightarrow\frac{0,4M}{n}+\frac{0,6M+21,3n}{n}=53,8\)
\(\Rightarrow M=32,5n\)
\(n=2\Rightarrow M=54\left(Zn\right)\)
Vậy kim loại M là kẽm (Zn)