Đốt cháy m gam hỗn hợp gồm CH4, C2H2, CxHy thu được 11 gam CO2 và 9 gam H2O.Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)\)
=> nC = 0,25 (mol)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=> nH = 1 (mol)
Do hỗn hợp chứa hidrocacbon
=> mhh = mC + mH = 12.0,25 + 1.1 = 4 (g)

\(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)=n_C\Rightarrow m_C=0,25.12=3\left(g\right)\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=1\left(mol\right)\Rightarrow m_H=1\left(g\right)\)
\(\Rightarrow m_{hh}=m_C+m_h=3+1=4\left(g\right)=m\)
nCO2=1144=0,25(mol)=nC⇒mC=0,25.12=3(g)nCO2=1144=0,25(mol)=nC⇒mC=0,25.12=3(g)
nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)
⇒mhh=mC+mh=3+1=4(g)=m

Ta có: \(n_{CO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=0,5.2=1\left(mol\right)\)
\(\Rightarrow m=m_C+m_H=0,7.12+1.1=9,4\left(g\right)\)

a, Ta có: \(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\Rightarrow n_H=0,6.2=1,2\left(mol\right)\)
m = mC + mH = 0,4.12 + 1,2.1 = 6 (g)
b, Theo ĐLBT KL, có: m + mO2 = mCO2 + mH2O
⇒ mO2 = 22,4 (g) \(\Rightarrow n_{O_2}=\dfrac{22,4}{32}=0,7\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,7.22,4=15,68\left(g\right)\)
\(\Rightarrow V_{kk}=\dfrac{15,68}{20\%}=78,4\left(g\right)\)

Đáp án B
Ta có:
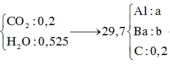
![]()
Chú ý: Số H có trong CH4 và C2H2 bằng số mol a nhương của Al và Ba trong các hợp chất tương ứng.
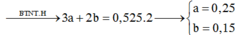
Vậy Y chứa:

Dùng kỹ thuật điền số điện tích:

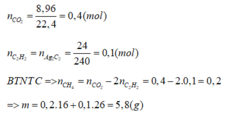


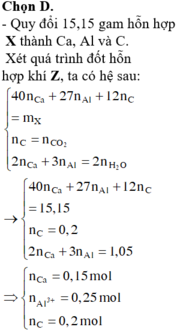

nCO2=11\44=0,25(mol)=nC⇒mC=0,25.12=3(g)
nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)
⇒mhh=mC+mh=3+1=4(g)=m
nCO2=11/44=0,25(mol) => nC=0,25.1=0,25(mol) => mC=0,25.12=3(g)
nH2O=9/18=0,5(mol) => nH=0,5.2=1(mol) => mH=1.1=1(g)
theo định luật bảo toàn nguyên tố ta có:
m=mC+mH=3+1=4(g)