Tiến hành nung 6,06 g muối nitrat của một kim loại kiềm thu được 5,1 g muối nitrit. Hỏi muối nitrit của kim loại đem phân hủy là gì ??
RNO3 -> RNO2 + O2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
Vì muối đem nhiệt phân là muối nitrat của kim loại kiềm nên gọi công thức của muối là RNO3.
Có phản ứng nhiệt phân:
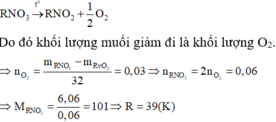

\(XNO_3\underrightarrow{^{to}}XNO_2+\frac{1}{2}O_2\)
\(n_{XNO_2}=\frac{7,65}{X+14+32}\left(1\right)\)
\(n_{XNO3}=\frac{9,09}{X+14+16.3}\left(2\right)\)
Ta có nXNO2 = nXON3
\(\Leftrightarrow\left(1\right)=\left(2\right)\)
\(\rightarrow X=39\left(K\right)\)
Vậy X là Kali
Nhưng đã biết kim loại kiềm hóa trị I hay II đâu mà có thể lập công thứ XNO3 vơi XNO2 vậy ạ?

mgiảm = mkhí = \(m_{NO_2}+m_{O_2}\)
Gọi muối kim loại đó là M(NO3)n
\(n_{M\left(NO_3\right)_n}=\dfrac{14,52}{M_M+62n}\left(mol\right)\)
PTHH: 4M(NO3)n --to--> 2M2On + 4nNO2 + nO2
\(\dfrac{14,52}{M_M+62n}\)--------->\(\dfrac{14,52n}{M_M+62n}\)-->\(\dfrac{3,63n}{M_M+62n}\)
=> \(46.\dfrac{14,52n}{M_M+62n}+32.\dfrac{3,63n}{M_M+62n}=9,72\)
=> \(M_M=\dfrac{56}{3}n\left(g/mol\right)\)
Xét n = 1 => Loại
Xét n = 2 => Loại
Xét n = 3 => MM = 56 (Fe)
bn thấy cái pthh của mình không :))
khối lượng chất rắn giảm là do có khí NO2, O2 thoát ra á :D

CT muối clorua của KL kiềm là MCl
2MCl -dpnc→ 2M + Cl2
Khí ở anot là Cl2. Số mol Cl2: 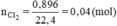
Số mol M là: nM = 0,04. 2 = 0,08 (mol)
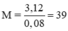 → M là K
→ M là K
Công thức muối KCl

Chọn đáp án B
nCl2 = 0,04 Þ nMCl = 0,08 = nM Þ M = 3,12/0,08 = 39 Þ M là K.

Đáp án C
(a) Đúng
(b) Sai vì 2 A g N O 3 → t 0 2 A g + N O 2 + O 2
(c) 2 C u ( N O 3 ) 2 → t o 2 C u O + 2 N O 2 + O 2
Giả sử có 1 mol C u ( N O 3 ) 2
![]()
⇒ đúng
(d) Đúng
Có thể nhận biết được vì Cu tan và sủi bọt khí NO không màu hóa nâu trong không khí

Đáp án C
(a(A) Đúng
(B(b) Sai vì
![]()
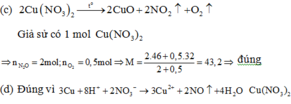
(Ccó thể nhận biết được vì Cu tan và sủi bọt khí NO không màu hóa nâu trong không khí

Vi la KL kiem nen PU la : RCl ---> R + 1/2 Cl2 , ncl2 =0.08 mol => n kl = 2*0.08= 0.16mol
M(kimloai) = 6.24/ 0.16 = 39 => kimloai la Kali Chon C