Bài tập áp dụng bảo toàn e
Bài 1: Cho 8,5 gam các kim loại Al và Mg tan hết trong dung dịch HNO3 loãng và H2SO4 loãng, thu được 11,2 lít (đktc) hỗ hợp khí B gồm NO và H2 có tỉ khối so với H2 là 8. Cô cạn dung dịch sau phản ứng thu được lượng muối khan ?
Bài 2: Hòa tan hoàn toàn 2,16 gam Al trong dung dịch HNO3 1M thu được 1,232 lít hỗn hợp B gồm NO và N2O (đktc). Tính tỷ khối của B so với H2
Bài 3: Hòa tan hoàn toàn 5,2g kim loại M vào dung dịch HNO3 dư thu được 1,008 lít (đktc) hỗn hợp 2 khí NO và N2O là sản phẩm khử duy nhất.Sau phản ứng khối lượng dung dịch tăng lên 3,78 gam so với ban đầu. Tìm M



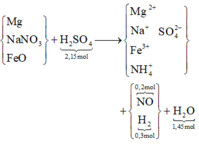
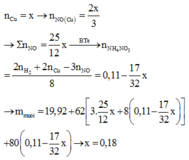
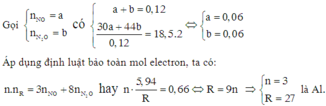
1,\(n_{hhB}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(d_{\frac{hhB}{H_2}}=\frac{\overline{M}}{2}=8\Rightarrow\overline{M}=16\)
ta có sơ đồ dường chéo:
=>\(\frac{n_{H_2}}{n_{NO}}=1\Rightarrow n_{H_2}=n_{NO}=0,25\left(mol\right)\)
ta có các quá trình nhường nhận e:
\(Mg^0\rightarrow Mg^{+2}+2e\) \(Al^0\rightarrow Al^{+3}+3e\)
\(N^{+5}+3e\rightarrow N^{+2}\) \(2H^{+1}+2e\rightarrow H_2^0\)
0,25................0,25 0,25
mNO3=0,25.62=15,5(g)
mSO4=0,25.96=24(g)
=>mmuối=mkl+mNO3+mSO4=8,5+15,5+24=48(g)
Bài này hqua mình làm rồi nên mình xóa nhé !