xác định công thức hóa học của hợp chất biết có chứa 28% kim loại, 24%S và 48%O về khối lượng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{Fe}=\%Fe.M_X=28\%.400=112\left(g\right)\\ m_S=\%S.M_X=24\%.400=96\left(g\right)\\ m_O=m_X-m_{Fe}-m_S=400-112-96=192\left(g\right)\)
\(\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_S=\dfrac{m}{M}=\dfrac{96}{32}=3\left(mol\right)\)
\(m_O=\dfrac{m}{M}=\dfrac{192}{16}=12\left(mol\right)\)
\(CTHH:Fe_2\left(SO_4\right)_3\)

1. CT của hợp chất : RO2 (do R hóa trị IV)
Ta có : \(\%R=\dfrac{R}{R+16.2}.100=50\)
=> R=32
Vậy R là lưu huỳnh (S), CTHH của hợp chất : SO2
2. CTHH của hợp chất tạo kim loại M ( hóa trị II) với nhóm SO4 là MSO4 (do M hóa trị II)
Ta có : \(\%M=\dfrac{M}{M+96}.100=20\)
=>M=24
Vây M là Magie (Mg), CTHH của hợp chất MgSO4

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)

Gọi công thức chung là FexSyOz
%O2=48%
x:y:z=\(\dfrac{28}{56}:\dfrac{24}{32}:\dfrac{48}{16}=0,5:0,75:3=2:3:12\)
=> CTHH Fe2(SO4)3
tên: Sắt (III)sunfat

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.
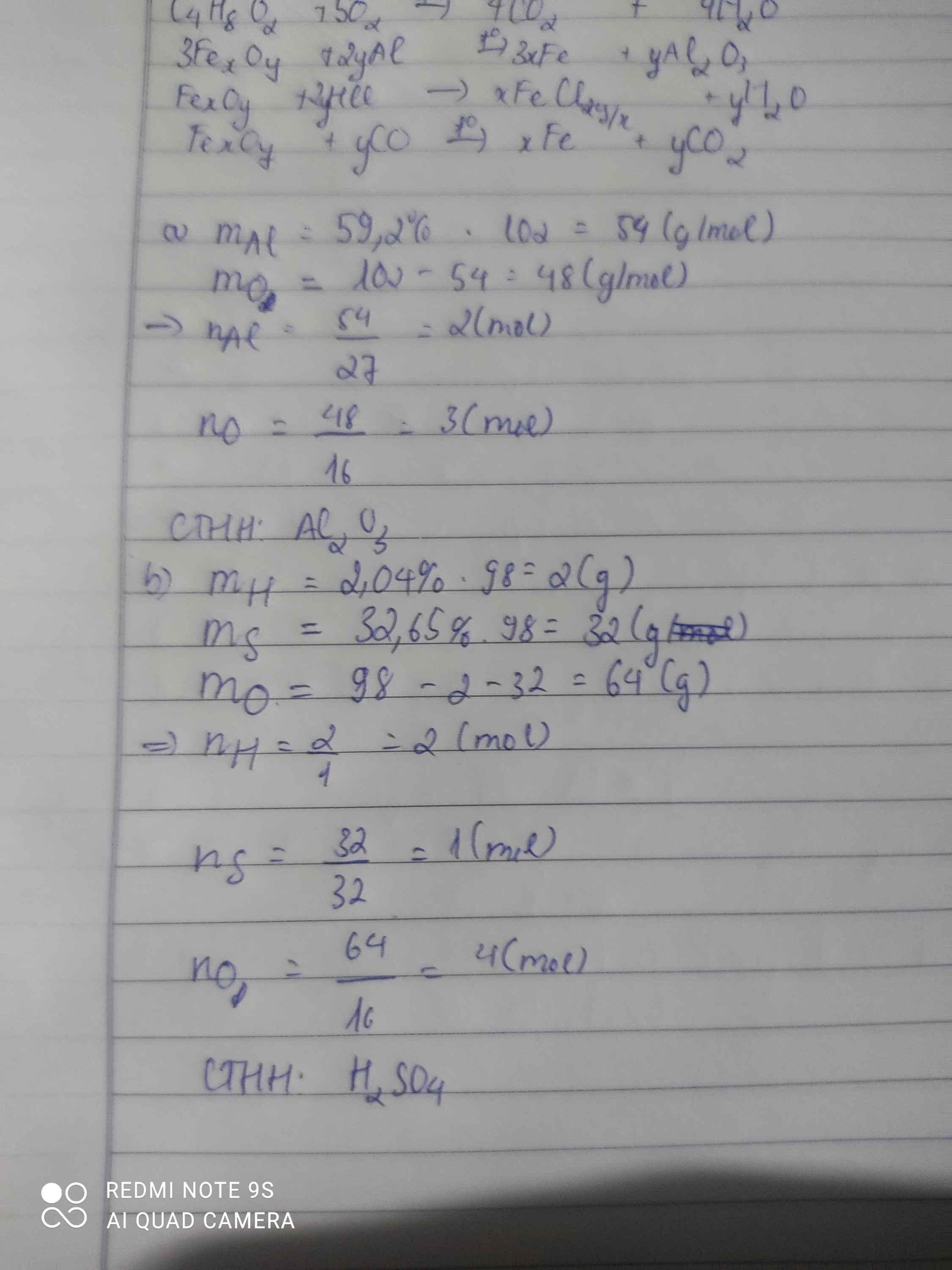
không ạ
Thiếu gì không bạn