Cho sản phẩm sau khi nung đến phản ứng hoàn toàn 5,6 gam Fe với 1,6 gam S vào 500 ml dung dịch HCl, thu được hỗn hợp khí bay ra và dung dịch A. a. Tính % (V) các khí trong B. b. Để trung hòa lượng axit dư trong A cần dùng 200 ml dung dịch NaOH 1M. Tính nồng độ mol dung dịch HCl đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,05<-0,05-->0,05
Fe + 2HCl --> FeCl2 + H2
0,05->0,1---->0,05-->0,05
FeS + 2HCl --> FeCl2 + H2S
0,05-->0,1----->0,05--->0,05
=> \(\%V_{H_2S}=\%V_{H_2}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
b)
nNaOH = 0,3 (mol)
- Gọi số mol HCl trong B là a (mol)
PTHH: NaOH + HCl --> NaCl + H2O
a<-----a
FeCl2 + 2NaOH --> Fe(OH)2 + 2NaCl
0,1---->0,2
=> a + 0,2 = 0,3
=> a = 0,1 (mol)
\(C_{M\left(FeCl_2\left(B\right)\right)}=\dfrac{0,1}{0,5}=0,2M\)
\(C_{M\left(HCl\left(B\right)\right)}=\dfrac{0,1}{0,5}=0,2M\)
nHCl(bđ) = 0,3 (mol)
=> \(C_{M\left(dd.HCl\left(bđ\right)\right)}=\dfrac{0,3}{0,5}=0,6M\)

Đáp án A
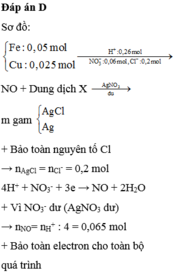
Từ phản ứng: 3e + 4H+ + NO3- → NO + 2H2O
=> X chứa Fe2+ (0,05 mol), Cu2+, H+, Cl- (0,2 mol).
Khi co X tác dụng với AgNO3 thu được kết tủa là AgCl (0,2 mol) và Ag (0,05 mol) => m ↓ = 34,1 (g)

Chọn A.
Từ phản ứng: 3e + 4H+ + NO3- ® NO + 2H2O
Þ X chứa Fe2+ (0,05 mol), Cu2+, H+, Cl- (0,2 mol).
Khi co X tác dụng với AgNO3 thu được kết tủa là AgCl (0,2 mol) và Ag (0,05 mol) Þ m¯ = 34,1 (g)




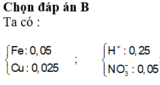

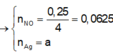
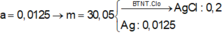

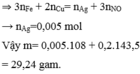
a,\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_S=\frac{1,6}{32}=0,05\left(mol\right)\)
\(PTHH:Fe+S\rightarrow FeS\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có:
\(n_{FeS}=n_S=0,05\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,1-0,05=0,05\left(mol\right)\)
\(\Rightarrow n_{H2S}=n_{H2}=0,05\left(mol\right)\)
\(\Rightarrow\%V_{H2S}=\%V_{H2}=50\%\)
b,\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(n_{HCl}=0,2+0,05.2+0,05.2=0,4\left(mol\right)\)
\(\Rightarrow CM_{HCl}=\frac{0,4}{0,5}=0,8M\)