Hòa tan hoàn toàn 18,4 g hỗn hợp X gồm kim loại R hóa trị II và RO bằng dung dịch axit H2SO4 loãng vừa đủ, người ta thu được 4,48 lít khí Hidro và dung dịch Y. Cô cạn từ từ dung dịch Y thu được 83,4 gam chất rắn Z
1, Xác định tên kim loại R biết trong X có tỉ lệ mol tương ứng của R và RO là 2 : 1
2, Xác định công thức hóa học của chất rắn Z.

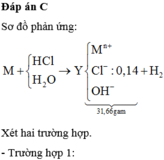


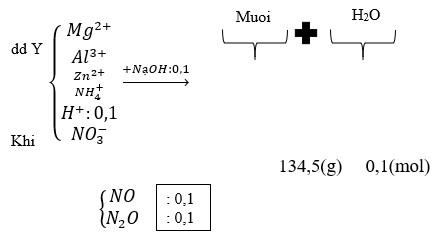

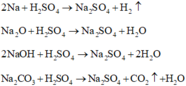

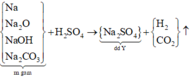
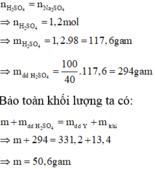
1,
nH2=0,2(mol) => nR=nH2=0,2(mol)
=> nRO=1/2 nR=0,1(mol)
=> mX=mR+ mRO=0,2MR + 0,1(MR +16) =18,4
=> MR = 56(g/mol) => R:Fe
2,
Fe + H2SO4 --> FeSO4 + H2 (1)
FeO +H2SO4 --> FeSO4 + H2O (2)
Theo (1,2) ta có :
nFeSO4 = nFe+ nFeO=0,3(mol)
=> mFeSO4 =45,6 (g) < 83,4 (g)
=> Z là tinh thể ngậm nước . Gỉa sử CTTQ của Z là FeSO4.nH2O
=> nFeSO4.nH2O= nFeSO4=0,3(mol)
=> MFeSO4.nH2O = \(\frac{83,4}{0,3}=278\) (g/mol)
=> n=7
Vậy Z là FeSO4.7H2O