Đốt cháy hoàn toàn 2,8 lít (đktc) hợp chất (Y), sản phẩm thu được cho qua bình đựng nước vôi trong dư, thấy khối lượng bình tăng thêm 23,25 gam và thu được 37,5 gam kết tủa. Biết khối lượng riêng khí Y (đktc) là 1,875 g/1. Công thức phân tử của Y là công thức nào sau đây?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nA = 2.8/22.4 = 0.125 (mol)
MA = 1.875 * 22.4 = 42 (g/mol)
=> mA = 42*0.125 = 5.25(g)
nCaCO3 = nCO2 = 37.5/100 = 0.375 (mol)
m bình tăng = mCO2 + mH2O = 23.25 (g)
=> mH2O = 23.25 - 0.375*44 = 6.75(g)
=> nH2O = 6.75/18 = 0.375 (mol)
mO = 5.25 - 0.375*12 - 0.375*2 = 0
CT : CxHy
x = 0.375/0.125 = 3
y = 0.375*2/0.125 = 6
CTPT : C3H6
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\)
\(n_{CO_2} = n_{CaCO_3} = \dfrac{37,5}{100} = 0,375(mol)\\ m_{H_2O} = m_{bình\ tăng} - m_{CO_2} \Rightarrow n_{H_2O} = \dfrac{23,25-0,375.44}{18} = 0,375(mol)\\ m_Y= 1,875.2,8 = 5,25(gam)\\ n_Y = \dfrac{2,8}{22,4} = 0,125(mol)\\ \Rightarrow M_Y = \dfrac{5,25}{0,125} = 42\)
Số nguyên tử Cacbon = \(\dfrac{n_{CO_2}}{n_Y} = \dfrac{0,375}{0,125} = 3\)
Số nguyên tử Hidro = \(\dfrac{2n_{H_2O}}{n_Y} = 6\)
Số nguyên tử Oxi = \(\dfrac{42-12.3-6}{16} = 0\)
Vậy CTPT của Y : C3H6

Ta có: \(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
\(n_C=n_{CO_2}=n_{CaCO_3}=\dfrac{30}{100}=0,3\left(mol\right)\)
⇒ mC + mH = 0,3.12 + 0,4.1 = 4 (g) < 10,4 (g)
→ A chứa C, H và O.
⇒ mO = 10,4 - 4 = 6,4 (g) ⇒ nO = 0,4 (mol)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,3:0,4:0,4 = 3:4:4
→ CTPT của A có dạng (C3H4O4)n.
Mà: \(n_{A\left(5,2\left(g\right)\right)}=n_{O_2}=\dfrac{1,6}{32}=0,05\left(mol\right)\Rightarrow M_A=\dfrac{5,2}{0,05}=104\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{104}{12.3+4+16.4}=1\)
Vậy: CTPT của A là C3H4O4.

Có lẽ đoạn đề ". có 50 gam... 13,6 gam." bị thừa bạn nhỉ?
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
\(n_{CO_2}=\dfrac{26,4}{44}=0,6\left(mol\right)=n_C\)
⇒ mC + mH = 0,6.12 + 0,6.1 = 7,8 (g) < 9,4 (g)
→ X gồm C, H và O.
⇒ mO = 9,4 - 7,8 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của X là CxHyOz.
⇒ x:y:z = 0,6:0,6:0,1 = 6:6:1
Mà: CTPT của X trùng với CTĐGN.
→ X là C6H6O.
- X có pư với NaOH → CTCT: C6H5OH.
\(n_X=\dfrac{4,7}{94}=0,05\left(mol\right)\), \(n_{NaOH}=0,1.1=0,1\left(mol\right)\)
PT: \(C_6H_5OH+NaOH\rightarrow C_6H_5ONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\), ta được NaOH dư.
Chất rắn thu được sau cô cạn gồm: NaOH dư và C6H5ONa.
Theo PT: \(n_{NaOH\left(pư\right)}=n_{C_6H_5ONa}=n_{C_6H_5OH}=0,05\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ m chất rắn = 0,05.40 + 0,05.116 = 7,8 (g)

Vì thu được một hiđrocacbon nên ankan và anken có cùng số nguyên tử C trong phân tử là n.
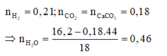
Do đó khi đốt cháy X thu được 0,18 mol CO2 và (0,46 - 0,2l) = 0,25 mol H2O
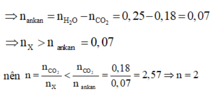
Đáp án A

Ta có :
$n_{CO_2} = n_{CaCO_3} = \dfrac{10}{100} = 0,1(mol)$
$\Rightarrow n_{H_2O} = \dfrac{7,1 - 0,1.44}{18} = 0,15(mol)$
Bảo toàn C, H :
$n_C = n_{CO_2} = 0,1(mol)$
$n_H = 2n_{H_2O} = 0,3(mol)$
$\Rightarrow n_O = \dfrac{2,3 - 0,1.12 - 0,3}{16} = 0,05(mol)$
$n_C : n_H : n_O = 0,1 : 0,3 : 0,05 = 2 : 6 : 1$
Vậy CTPT của X có thể là $C_2H_6O$
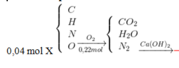



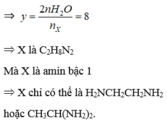
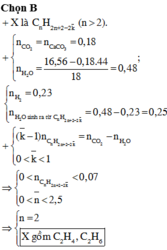

\(n_{CO2}=n_{CaCO3}=\frac{37,5}{100}=0,375\left(mol\right)\)
\(\Rightarrow m_{CO2}=16,5\left(g\right)\)
\(m_{bt}=m_{CO2}+m_{H2O}\Rightarrow m_{H2O}=6,75\left(g\right)\)
\(\Rightarrow n_H=2n_{H2O}=\frac{6,75.2}{18}=0,75\left(mol\right)\)
\(n_C=n_{CO2}\Rightarrow m_C=0,375.12=4,5\left(g\right)\)
\(\Rightarrow m_H=0,75\left(g\right)\)
\(V_Y=2,8\left(l\right)\Rightarrow m_Y=2,8.1,875=5,25\left(g\right)\)
\(n_Y=\frac{2,8}{22,4}=0,125\left(mol\right)\)
\(\Rightarrow M_Y=\frac{5,25}{0,125}=42\)
\(m_C+m_H=4,5+0,75=5,25\left(g\right)\Rightarrow\) Y gồm C và H
\(n_C:n_H=0,375:0,75=1:2\)
\(\Rightarrow CTĐGN:\left(CH_2\right)_n\)
\(M=42\Rightarrow n=3\left(C_3H_6\right)\)