Kim loại R hòa tan hết trong dung dịch HCl được 25,4 gam muối khan. Cũng lượng kim loại trên tác dụng với khí Cl2 dư thu được 32,5 gam muối. Kim loại R là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Fe + 3 Cl 2 → t ° 2Fe Cl 3 ( M FeCl 3 = 162,5 gam)
Cu + Cl 2 → t ° Cu Cl 2
Fe + 2HCl → Fe Cl 2 + H 2 ( M FeCl 2 = 127 gam)
n Fe = x mol
Theo đề bài và phương trình hóa học trên ta có:
127x = 25,4 => 0,2 mol
162,5x + 135y = 59,5. Thay x = 0,2 vào phương trình, ta có:
32,5 + 135y = 59,5 => y = 0,2
m FeCl 3 = 0,2 x 162,5 = 32,5g
m CuCl 2 = 0,2 x 135 = 27g
% m FeCl 3 = 32,5 : (32,5 + 27).100% = 54,62%
% m CuCl 2 = 100% - 54,62% = 45,38%

m axit cần dùng = 0,2 x 2 x 36,5 = 14,6g
m dung dịch HCl = 146g => V dd HCl = 146/1 = 146ml

Chọn đáp án B
nCrCl2 = 36,9/123 = 0,3 Þ mCrCl3 = 0,3x158,5 = 47,55 gam

Ta có phản ứng:
X + HCl \(\rightarrow\) XCl + 1/2H2 (1)
m 36,5x 26,6 g x (g)
Dung dịch Y chứa XCl và HCl dư (có cùng nồng độ nên sẽ có cùng số mol).
Nếu gọi x là số mol của XCl thì 0,4 - x sẽ là số mol của HCl dư. Do đó: x = 0,4 - x, suy ra: x = 0,2 (mol).
Áp dụng định luật bảo toàn khối lượng cho phương trình (1), thu được: m + 36,5x = 26,6 + x. Như vậy: m = 19,5 (g).
2X + Cl2 \(\rightarrow\) 2XCl (2)
m 0,1.71 m1 (g)
m1 = m + 7,1 = 26,6 (g).

Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B

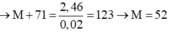
\(R+2HCl\rightarrow RCl_2+H_2\)
\(2R+3Cl_2\rightarrow2RCl_3\)
\(\Leftrightarrow\frac{25,4}{M_R+71}=\frac{32,5}{M_R+106,5}\)
\(\Rightarrow M_R=56\)
Vậy kim loại R là Fe