8: Sắt oxit có tỉ lệ khối lượng giữa sắt và oxi là 21 : 8. Công thức hóa học của sắt oxit đó là:
a) FeO b) Fe2O3 c) Fe3O4 d) Khác
Hãy tìm công thức hóa học của hợp chất X có thành phần các nguyên tố như sau: 80%Cu và 20%O.
9: Đốt cháy hoàn toàn 3,1 g Photpho trong không khí, thu được 7,1 g Điphotpho pentaoxit (P2O5)
a) Viết phương trình chữ của phản ứng.
b) Tính khối lượng của oxi đã phản ứng
10:Nung 160 gam sắt (III) hiđroxit (Fe(OH)3), thu được m gam sắt (III) oxit (Fe2O3) và 40 gam nước.
a) Lập phương trình hoá học của phản ứng.
b) Tính khối lượng sắt III hiđroxit tạo thành.
a) Tính thể tích khí oxi (ở đktc) cần dùng để đốt cháy hết 1,6 gam bột lưu huỳnh.
b) Tính khối lượng khí sunfuro (SO2) tạo thành.
11: Đốt cháy 6,2 gam photpho trong một bình chứa 6,72 lít khí O2 (ở đktc).
a) Viết phương trình hóa học xảy ra.
b) Sau phản ứng photpho hay oxi dư? Số mol chất còn dư là bao nhiêu?.
c) Tính khối lượng chất tạo thành
12. Khi đốt lưu huỳnh ngoài không khí, sau đó đưa vào bình khí oxi, lưu huỳnh cháy sáng mạnh hơn là do đâu ?




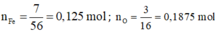
9
có phương trình: 4 P + 5 O2 → 2 P2O5 ( nhớ có nhiệt độ ấy nhé)
Áp dụng ĐLBTKL có: mP + m O2 = m P2O5
hay 3,1 + m O2 = 7,1 ↔ m O2 = 4 g
11
4P+5O2=to=>2P2O5
nP=6,2\31=0,2(mol);nO2=6,72\22,4=0,3(mol)
Theo PTHH, ta có: 0,2\4<0,3\5=>O2 dư
nO2(dư)=0,3−(0,2.54)=0,05(mol)
mO2(dư)=0,05.32=1,6(g)
nP2O5=2\4.nP=2\4.0,2=0,1(mol)
mP2O5=0,1.142=14,2(g)
12
Quan sát nhận xét: lưu huỳnh cháy trong k khí vs ngọn lửa nhỏ,màu xanh nhạt; cháy trong oxi mãnh liệt hơn,tạo thành khí lưu huỳnh đioxit SO2 và rất ít lưu huỳnh trioxit (S03)
PTHH: S+ 02--t°--SO2