tính sự khi phân tích một mẫu quặng apatit Ca3(Po4)2 có chứa 6,2 gam photpho. Hỏi mẫu quặng trên có chứa bao nhiêu gam Ca3(PO4)2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Ca\left(H_2PO_4\right)_2}=\dfrac{234}{234}=1\left(kmol\right)\)
Từ PTHH ta thấy :
\(n_{Ca_3\left(PO_4\right)_2}=\dfrac{1}{3}\left(kmol\right)\)
\(n_{Ca_3\left(PO_4\right)_2\left(tt\right)}=\dfrac{1}{3\cdot80\%}=\dfrac{5}{12}\left(kmol\right)\)
\(m_{Ca_3\left(PO_4\right)_2}=\dfrac{5}{12}\cdot310=\dfrac{775}{6}\left(kg\right)\)
\(m_{quặng}=\dfrac{775}{6\cdot38.75\%}=333.3\left(kg\right)\)

Trong 1000g quặng có: 1000. 35% = 350g Ca3(PO4)2
Bảo toàn nguyên tố P ⇒ trong 1 mol Ca3(PO4)2 có 1mol P2O5 nghĩa là trong 310g Ca3(PO4)2 tương ứng có 142g P2O5.
⇒350g Ca3(PO4)2 có lượng P2O5 là:
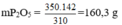
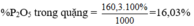

Đáp án B
Giả sử khối lượng phân là 100g
⇒ mCa3(PO4)3 = 35 gam.
Bảo toàn nguyên tố ta có:
Ca3(PO4)2 → P2O5.
⇒ mP2O5 = 35 × 142/310 = 16,03 gam.
⇒ Độ dinh dưỡng của phân bón đã cho = ![]() = 16,03%.
= 16,03%.

Đáp án B
Giả sử khối lượng phân là 100g ⇒ mCa3(PO4)3 = 35 gam.
Bảo toàn nguyên tố ta có: Ca3(PO4)2 → P2O5.
⇒ mP2O5 = 35 × 142/310 = 16,03 gam.
⇒ Độ dinh dưỡng của phân bón đã cho = 16,03×100/100 = 16,03%.
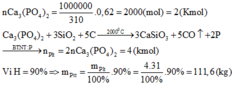
\(n_P=\frac{6,2}{31}=0,2\left(mol\right)\)
\(n_{Ca3\left(PO4\right)2}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(m_{Ca3\left(PO4\right)2}=370.0,1=37\left(g\right)\)
\(n_P=\frac{6,2}{31}=0,2\left(mol\right)\)
\(n_{Ca3\left(PO4\right)2}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(m_{Ca3\left(PO4\right)2}=0,1.310=31\left(g\right)\)