Tính hiệu suất phản ứng điều chế oxi từ kaliclorat biết rằng đi từ 24,5g KClO3 thu được 5,376 lít khí oxi (đktc).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60%

Số mol KClO3 là:
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH
\(2KClO_3\rightarrow2KCl+3O_2\)
0,2 mol.....................0,3mol
lượng oxi thu dc trên lý thuyết là:
\(m_{O_2}=0,3.32=9.6\left(g\right)\)
Lượng oxi thu dc thực tế là:
\(m_{O_2thucte}=9,6.60\%=5,76\left(g\right)\)

C1
\(m_{KClO_3\left(pư\right)}=\dfrac{24,5.60}{100}=14,7\left(g\right)\)
\(n_{KClO_3\left(pư\right)}=\dfrac{14,7}{122,5}=0,12\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,12--------->0,12--->0,18
=> \(m_{O_2}=0,18.32=5,76\left(g\right)\)
C2: \(m_{KCl}=0,12.74,5=8,94\left(g\right)\)
Theo ĐLBTKL: \(m_{KClO_3\left(pư\right)}=m_{KCl}+m_{O_2}\)
=> \(m_{O_2}=14,7-8,94=5,76\left(g\right)\)

Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)

a) 2KClO3 (7/75 mol) \(\underrightarrow{t^o}\) 2KCl (7/75 mol) + 3O2\(\uparrow\) (0,14 mol).
b) Số mol khí oxi là 4,48/32=0,14 (mol).
Khối lượng kali clorat cần dùng là 7/75.122,5=343/30 (g).
Khối lượng chất rắn thu được là 7/75.74,5=1043/150 (g).
\(a,PTHH:2KClO_3\underrightarrow{t^o,MnO_2}2KCl+3O_2\uparrow\\ b,n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ Theo.pt:n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5=\dfrac{49}{3}\left(g\right)\)

\(n_{O_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ PTHH:2KClO_3-^{t^o}>2KCl+3O_2\)
tỉ lệ 2 : 2 : 3
n(mol) `1/3`<------------`1/3`<-----`0,5`
\(m_{KClO_3}=n\cdot M=\dfrac{1}{3}\cdot\left(39+35,5+16\cdot3\right)\approx40,83\left(g\right)\)

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

\(n_{O_2}=\dfrac{43.2}{32}=1.35\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(0.9...........................1.35\)
\(H\%=\dfrac{0.9}{1}\cdot100\%=90\%\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______1_____________1,5 (mol)
⇒ mO2 (lí thuyết) = 1,5.32 = 48 (g)
Mà: mO2 (thực tế) = 43,2 (g)
\(\Rightarrow H\%=\dfrac{43,2}{48}.100\%=90\%\)
Bạn tham khảo nhé!

PTHH :
\(2KClO_3\overrightarrow{t^o}2KCl+3O_2\uparrow\)
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
Theo PTHH :
\(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,15\left(mol\right)\)
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
\(V_{O_{2thucte}}=3,36.80\%=2,688\left(l\right)\)
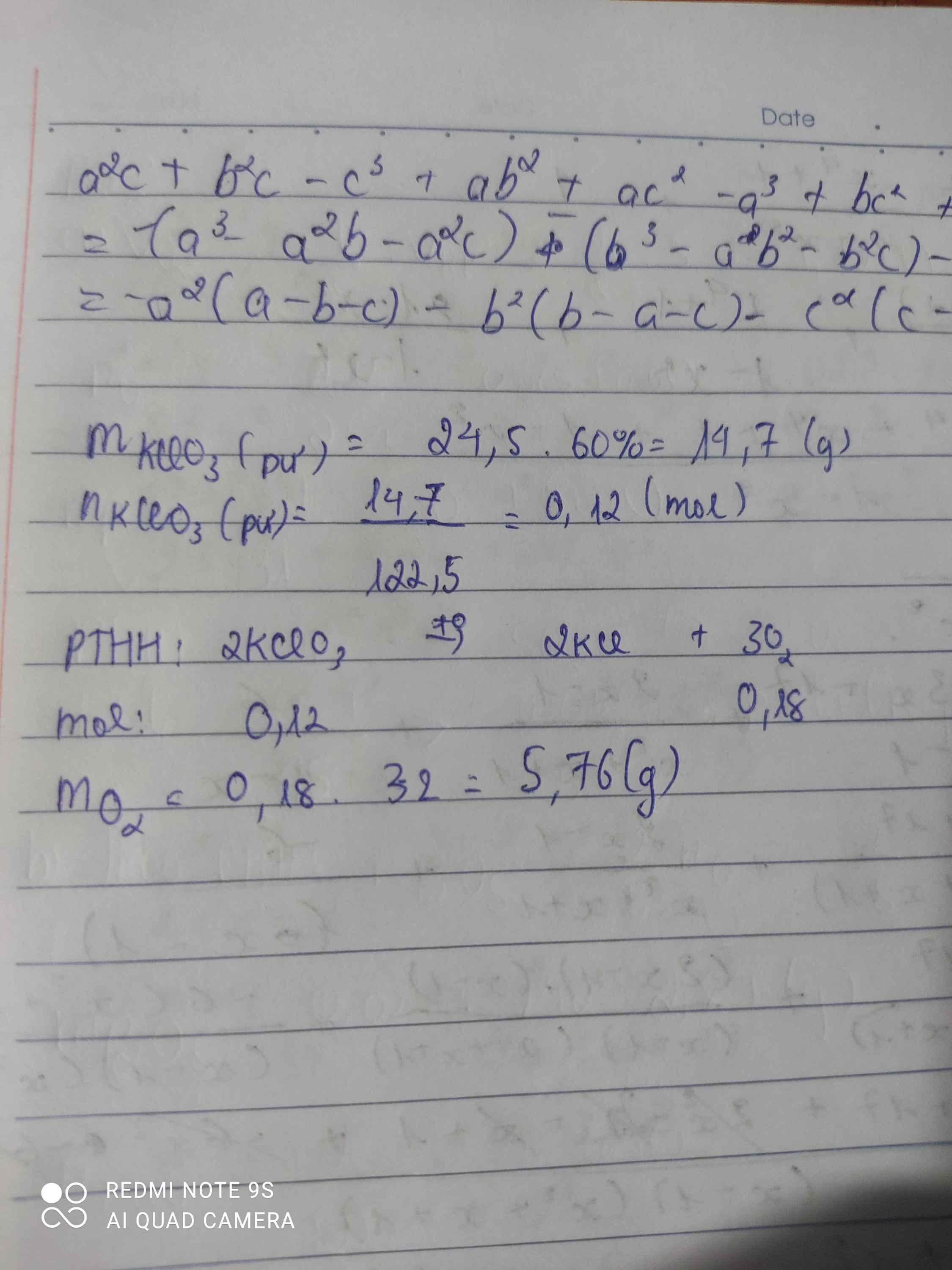
Tính hiệu suất phản ứng điều chế oxi từ kaliclorat biết rằng đi từ 24,5g KClO3 thu được 5,376 lít khí oxi (đktc).
---------
nKClO3= 24,5/122,5=0,2(mol)
nO2(TT)= 5,376/22,4= 0,24 (mol)
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
0,2______________________0,3(mol)
nO2(LT)= 0,3(mol)
=> H = (0,24/0,3).100= 80%