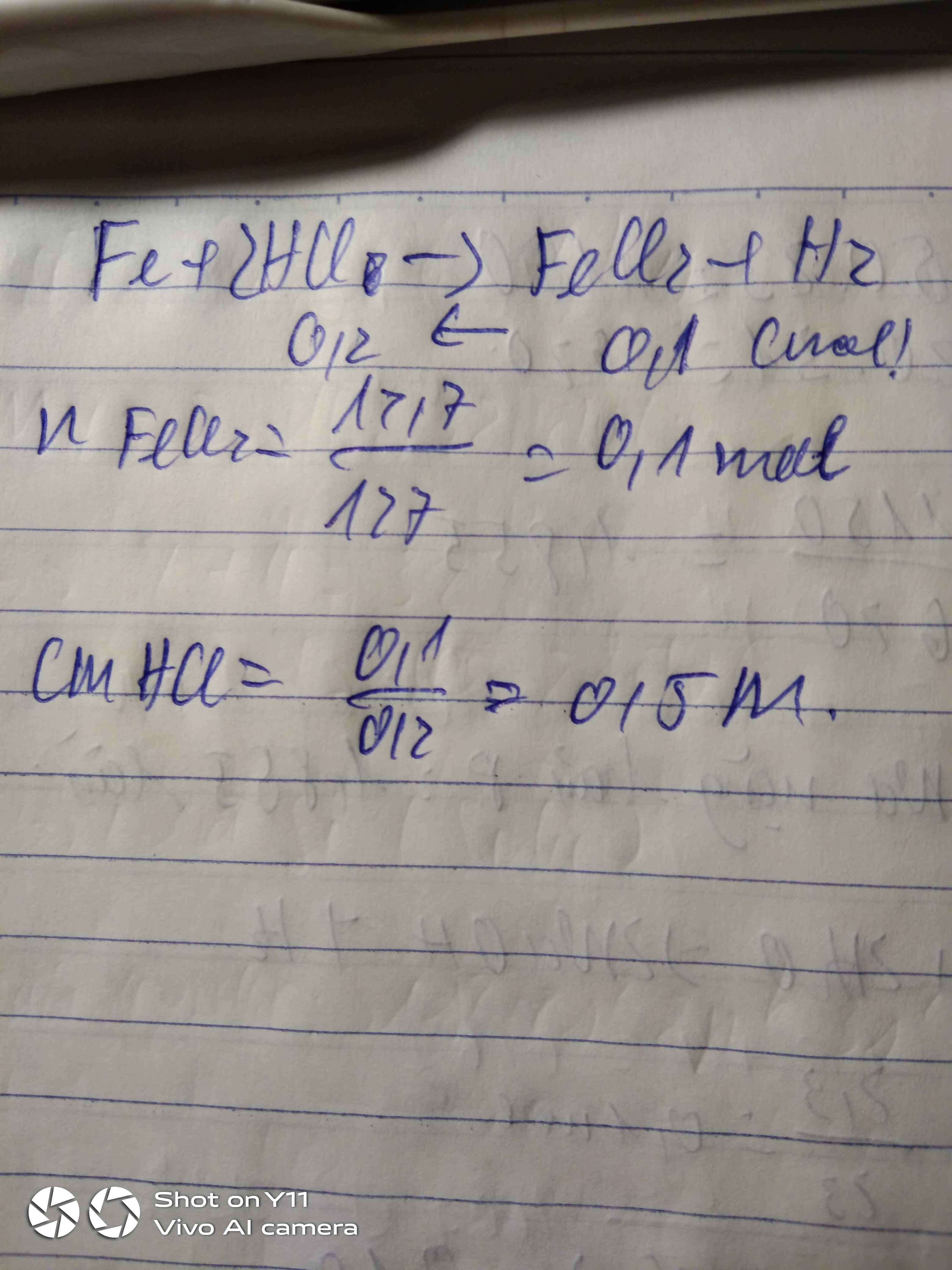Hòa tan 7,2 gam Magie trong 200 gam dd HCl vừa đủ. Tính nồng độ % dung dịch thu được và C% dung dịch HCl đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a. PTHH: \(Mg+2HCl--->MgCl_2+H_2\)
Theo PT: \(n_{Mg}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
Theo PT: \(n_{HCl}=2.n_{Mg}=2.0,2=0,4\left(mol\right)\)
=> \(m_{HCl}=0,4.36.5=14,6\left(g\right)\)
=> \(C_{\%_{HCl}}=\dfrac{14,6}{200}.100\%=7,3\%\)
b. Ta có: \(m_{dd_{MgCl_2}}=4,8+200=204,8\left(g\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\)
=> \(m_{MgCl_2}=0,2.95=19\left(g\right)\)
=> \(C_{\%_{MgCl_2}}=\dfrac{19}{204,8}.100\%=9,28\%\)

mH2SO4= \(\dfrac{300.7,35}{100}=22,05g\)
nH2SO4= \(\dfrac{22,05}{98}=0,225 mol\)
mHCl= \(\dfrac{200.7,3}{100}=14,6g\)
nHCl= \(\dfrac{14,6}{36,5}=0,4mol\)
H2SO4 + 2HCl → 2H2O + Cl2 ↑+ SO2 ↑
n trước pư 0,225 0,4
n pư 0,2 ← 0,4 → 0,4 → 0,2 → 0,2 mol
n sau pư dư 0,025 hết
a) mCl2= 0,2. 71= 14,2g
mSO2= 64. 0,2= 12,8g
mH2O= 18. 0,4=7,2g
mdd sau pư= 300 +200 -14,2 -12,8= 473g
C%dd H2O= \(\dfrac{7,2.100}{473}=1,52\)%
b) Mg + 2H2O → Mg(OH)2 + H2 ↑
x → 2x → x → x
Fe + 2H2O → Fe(OH)2 + H2↑
y → 2y → y → y
Gọi x,y lần lượt là số mol của Mg,Fe.
Ta có hệ phương trình:
24x + 56y = 8,7 x= \(\dfrac{5}{64}\)
⇒
2x + 2y = 0,4 y= \(\dfrac{39}{320}\)
VH2= 22,4. \((\dfrac{5}{64}+\dfrac{39}{320})\)= 4,48l
mhh MG(OH)2, Fe(OH)2= 8,7 +250 - 2.(\(\dfrac{5}{64}+\dfrac{39}{320}\)) = 2258,3g
mMg=24. \(\dfrac{5}{64}\)=1.875g
mFe= 8,7-1,875= 6,825g

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a_____a (mol)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b_____3b_______b_____\(\dfrac{3}{2}\)b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27b=36,1\\a+\dfrac{3}{2}b=\dfrac{21,28}{22,4}=0,95\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,5\\b=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,5\cdot56=28\left(g\right)\\m_{Al}=8,1\left(g\right)\end{matrix}\right.\)
b+c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{HCl}=2a+3b=1,9\left(mol\right)\\n_{FeCl_2}=0,5\left(mol\right)\\n_{AlCl_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{HCl}}=\dfrac{1,9}{0,2}=9,5\left(M\right)\\C_{M_{FeCl_2}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\\C_{M_{AlCl_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)

\(n_{K2O}=\dfrac{9,4}{94}=0,1\left(mol\right)\)
Pt : \(K_2O+H_2O\rightarrow2KOH|\)
1 1 2
0,1 0,2
a) \(n_{KOH}=\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddKOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
b) Pt : \(KOH+HCl\rightarrow KCl+H_2O|\)
1 1 1 1
0,1 0,1
\(n_{HCl}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{HCl}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=\dfrac{3,65.100}{10}=36,5\left(g\right)\)
c) \(CO_2+2KOH\rightarrow K_2CO_3+H_2O|\)
1 2 1 1
0,05 0,1
\(n_{CO2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
\(V_{CO2\left(dktc\right)}=0,05.22,4=1,12\left(l\right)\)
Chúc bạn học tốt

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(n_{H_2}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{MgCl_2}=n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Mg}=0,4.24=9,6\left(g\right)\)
c, \(m_{MgCl_2}=0,4.95=38\left(g\right)\)
d, Bạn bổ sung thêm thể tích dd HCl nhé.

a)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4----->0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) mHCl = 0,4.36,5 = 14,6 (g)
=> \(m_{dd.HCl}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
c)
mdd sau pư = 13 + 200 - 0,2.2 = 212,6 (g)
mZnCl2 = 0,2.136 = 27,2 (g)
=> \(C\%=\dfrac{27,2}{212,6}.100\%=12,8\%\)