Đốt cháy hoàn toàn 2,4g trong không khí thu được m gam oxit
a)Tính thể tích oxi đã dùng ở đktc
b)Tính khối lượng MgO tạo thành
c)Tính khối lượng KClO3 cần dùng để khi phân hủy thì thu được một thể tích khí Oxi ở đktc bằng với thể tích khí oxi đã sử dụng ở phản ứng trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)

a)\(n_{Fe}=\dfrac{22,4}{56}=0,4mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,4 \(\dfrac{4}{15}\) \(\dfrac{2}{15}\)
\(V_{O_2}=\dfrac{4}{15}\cdot22,4=5,973l\)
b)\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{8}{45}\) \(\dfrac{4}{15}\)
\(m_{KClO_3}=\dfrac{8}{45}\cdot122,5=21,78g\)

a, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
b, Ta có: \(n_{MgO}=\dfrac{2,4}{40}=0,06\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{MgO}=0,03\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,03.22,4=0,672\left(l\right)\)
c, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,02\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=0,02.122,5=2,45\left(g\right)\)

nMg = 7,2/24 = 0,3 (mol)
PTHH: 2Mg + O2 -> (t°) 2MgO
Mol: 0,3 ---> 0,15 ---> 0,3
VO2 = 0,15 . 22,4 = 3,36 (l)
Vkk = 3,36 . 5 = 16,8 (l)
mMgO = 0,3 . 40 = 12 (g)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,225\left(mol\right)\Rightarrow V_{O_2}=0,225.22,4=5,04\left(l\right)\)
c, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,15\left(mol\right)\Rightarrow m_{KClO_3}=0,15.122,5=18,375\left(g\right)\)

\(n_{Fe}=\dfrac{126}{56}=2,25\left(mol\right)\\
pthh:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
2,25 1,5
=> \(V_{O_2}=1,5.22,4=33,6\left(L\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
1 1,5
=> \(m_{KClO3}=122,5\left(g\right)\)

a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)

1. a. \(PTHH:2Mg+O_2\overset{t^o}{--->}2MgO\left(1\right)\)
b. Ta có: \(n_{Mg}=\dfrac{24}{24}=1\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}.0,1=0,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,5.22,4=11,2\left(lít\right)\)
c. \(PTHH:2KClO_3\xrightarrow[t^o]{MnO_2}2KCl+3O_2\left(2\right)\)
Theo PT(2): \(n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,5=\dfrac{1}{3}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{1}{3}.122,5=40,83\left(g\right)\)
2. \(PTHH:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
a. Theo PT: \(n_{Fe}=3.n_{Fe_3O_4}=0,01.3=0,03\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
b. Theo PT: \(n_{O_2}=2.n_{Fe_3O_4}=2.0,01=0,02\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,02.22,4=0,448\left(lít\right)\)

\(n_{Fe}=\dfrac{1,68}{56}=0,03\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,03 0,02 0,01 ( mol )
\(m_{Fe_3O_4}=0,01.232=2,32\left(g\right)\)
\(V_{kk}=0,02.22,4.5=2,24\left(l\right)\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
\(\dfrac{1}{75}\) 0,02 ( mol )
\(m_{KClO_3}=\dfrac{1}{75}.122,5=1,63\left(g\right)\)
a,nFe=1,68/56=0,03 mol
Ta có PTHH : 3Fe + 2O2 --> Fe3O4 (1) ( ở trên dấu --> có to nha )
Theo PTHH ta có :
nFe3O4=1/3nFe=1/3.0,03=0,01 mol
nO2=2/3nFe=2/3.0,03=0,02 mol
=>mFe3O4= 0,01.232=2,32g
=>Vkk=5.(0,02.22,4)=2,24 l
b, Ta có PTHH: 2KClO3 --> 2KCl + 3O2 (2) ( trên dấu --> vẫn có to )
Gọi x là số mol KClO3 cần dùng ( x > 0 )
Theo PTHH (3) và theo bài ra ta có PTHH sau:
2/3x=0,02
=> x=0,03 mol
=> mKClO3= 0,03.122,5= 3,675g
![]()

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,2\left(mol\right)\Rightarrow m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
c, \(n_{O_2}=\dfrac{5}{4}n_P=0,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,5.22,4=11,2\left(l\right)\)
d, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{3}\left(mol\right)\Rightarrow m_{KClO_3}=\dfrac{1}{3}.122,5=\dfrac{245}{6}\left(g\right)\)
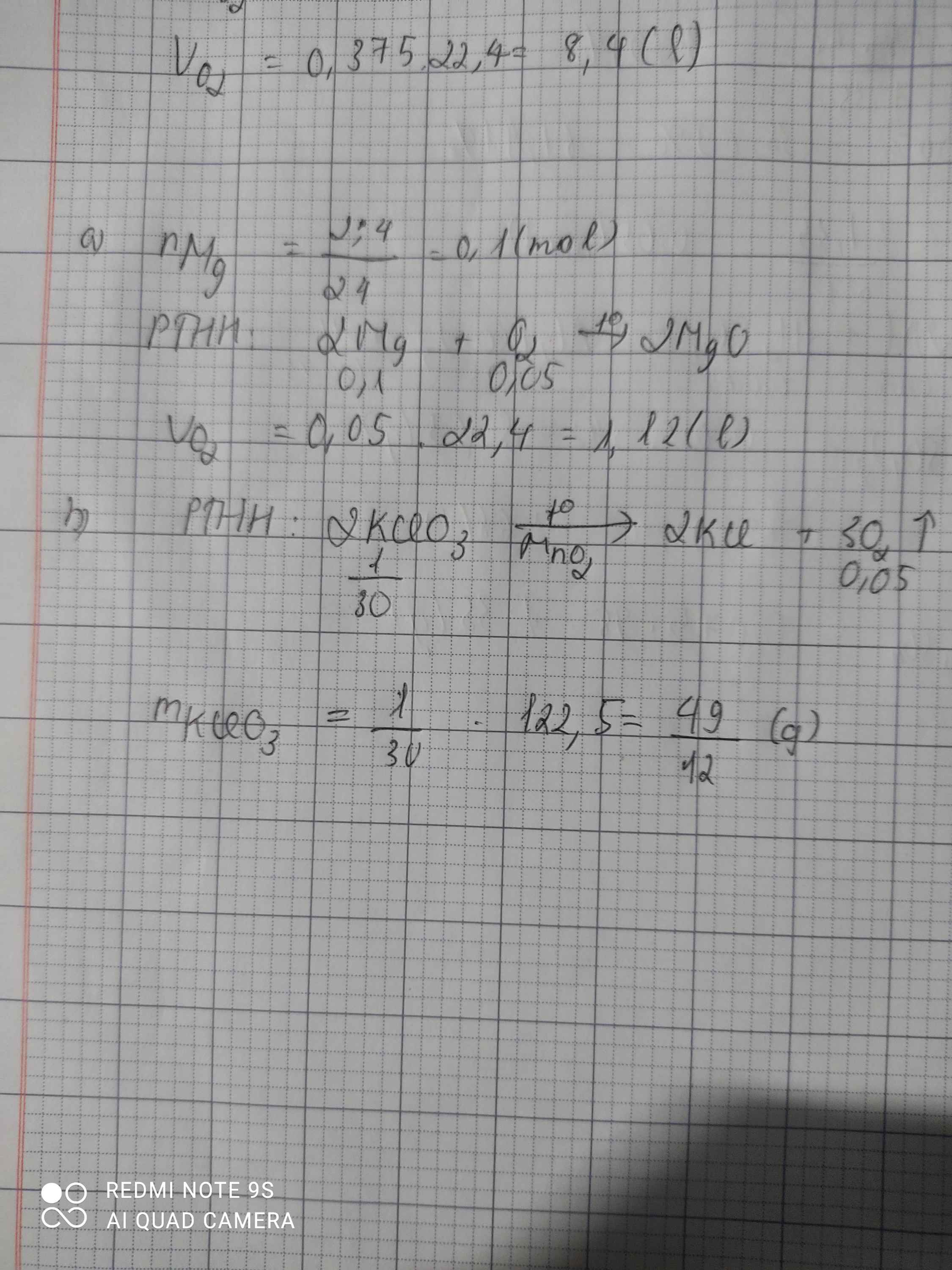
\(n_{Mg}=0,1\left(mol\right)\)
\(2Mg+O_2\underrightarrow{^{to}}2MgO\)
\(\Rightarrow n_{O2}=0,05\left(mol\right);n_{MgO}=0,1\left(mol\right)\)
\(\Rightarrow V_{O2}=0,05.22,4=1,12\left(l\right)\)
\(m_{MgO}=0,1.40=4\left(g\right)\)
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
\(n_{KClO3}=\frac{0,1}{3}\left(mol\right)\)
\(\Rightarrow_{KClO3}=4,08\left(g\right)\)
2Mg+o2-->2MgO
0,1 ------0,05-----0,1 mol
nMg=2,4\24=0,1 mol
=>Vo2=0,05.22,4=1,12 mol
b)mMgO=0,1.40=4 g
2KClO3-->2KCl+3O2
0,07----------------1 mol
mKClO3=0,07.122,5=8,575 g