hỗn hợp 3 muối NaF, NaCl, NaBr nặng 4,82g hoàn tan hoàn toàn vào nước được dd A. sục khí clo dư vào dd A rồi cô cạn hoàn toàn dd sau phản ứng thu được 3,93g muối khan. lấy một nửa lượng muối khan này hòa tan vào nước rồi cho phản ứng với dd AgNO3 dư thì thu được 4,305g kết tủa. viết các PTPƯ xảy ra và tính thành phần % khối lượng mỗi muối trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
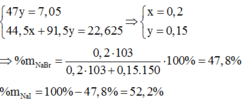

\(\left\{{}\begin{matrix}nNaCl=x\\nNaBr=y\\nNaI=z\end{matrix}\right.\)
ta có : \(58,5x+103y+150z=5,76\left(1\right)\)
TN1:
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
z ----> z
\(\Rightarrow m_{muối}=mNaBr+mNaCl=103\left(y+z\right)+58,5x=5,29\left(2\right)\)
Từ (1) và (2) => z =0,01
TN2:
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
0,01 0,01
\(Cl_2+2NaBr\rightarrow2NaCl+I_2\)
\(nNaCl=nCl^-=0,05\rightarrow mNaCl=2,925\left(g\right)\)muối khan ngoài NaCl còn muối khác.Do \(I^-\) có tính khử mạnh hơn \(Br^-\) nên NaI sẽ hết trước và sau hai phản ứng NaBr còn dư.
\(nNaBr\left(dư\right)=t\)
\(\Rightarrow nNaCl=0,05=0,01+y-t+x\)
\(m_{muối}=mNacl+mNaBr\Rightarrow mNaBr_{\left(dư\right)}=3,955-0,05.58,5=1,03\)
\(\Rightarrow t=0,01\)
\(\Rightarrow x+y=0,05\left(3\right)\)
(1) ; (3) ; => \(x=0,02;y=0,03\)
\(\Rightarrow mNaCl=1,17\left(g\right)\)

Đáp án B
Gọi x, y là số mol NaCl và NaI trong hh X
m(X) = m(NaCl) + m(NaI) = 58,5x + 150y = 104,25g (1)
Sục khí Cl2 dư vào dd A:
NaI + 1/2Cl2 → 1/2I2 + NaCl
y → y
mmuối = m(NaCl) = 58,5.(x+y) = 58,5g
→ x + y = 1mol (2)
Giải hệ PT (1), (2) ta được: x = 0,5mol và y = 0,5mol
mNaCl = 0.5.58,5 = 29,25 (g)

Ta có: \(n_{CO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{HCl}=0,4.1,5=0,6\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Na_2CO_3}=x\left(mol\right)\\n_{K_2CO_3}=y\left(mol\right)\end{matrix}\right.\)
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\)
\(K_2CO_3+2HCl\rightarrow2KCl+H_2O+CO_2\)
\(HCl_{dư}+NaOH\rightarrow NaCl+H_2O\)
Theo PT: \(n_{CO_2}=n_{Na_2CO_3}+n_{K_2CO_3}=x+y\left(mol\right)\) ⇒ x + y = 0,25 (1)
\(n_{HCl\left(pư\right)}=2x+2y\left(mol\right)\) \(\Rightarrow n_{HCl\left(dư\right)}=0,6-2x-2y\left(mol\right)\)
Có: \(\left\{{}\begin{matrix}n_{NaCl}=2n_{Na_2CO_3}+n_{HCl\left(dư\right)}=0,6-2y\left(mol\right)\\n_{KCl}=2n_{K_2CO_3}=2y\left(mol\right)\end{matrix}\right.\)
⇒ 58,5(0,6 - 2y) + 74,5.2y = 39,9 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Na_2CO_3}=\dfrac{0,1.106}{0,1.106+0,15.138}.100\%\approx33,9\%\\\%m_{K_2CO_3}\approx66,1\%\end{matrix}\right.\)
Bạn tham khảo nhé!

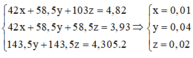
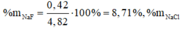
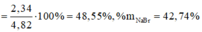
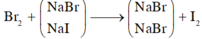
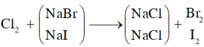
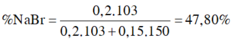

Đáp án:
%mNaF=45,12%; %mNaCl=12,1% ->%mNaBr=42,78%
Giải thích các bước giải:
Hỗn hợp A chứa NaF x mol , NaCl y mol và NaBr z mol
-> 42x+58,5y+103z=4,82
Sục Cl2 dư vào dung dịch A thì Cl2 chỉ phản ứng với NaBr
Cl2 + 2NaBr -> 2NaCl + Br2
Sau phản ứng A chứa NaF x mol và NaCl (y+z ) mol
-> 42x+58,5(y+z)=3,93
Cho lượng muối trên tác dụng với AgNO3 thì có có NaCl phản ứng
NaCl + AgNO3 -> AgCl + NaNO3
-> nAgCl=nNaCl=y+z=4,305/143,5=0,03 mol
Giải được: x=29/560; y=0,01; z=0,02
-> mNaF=2,175 gam; mNaCl=0,585 gam; mNaBr=2,06 gam
->%mNaF=45,12%; %mNaCl=12,1% ->%mNaBr=42,78%