1) Hòa tan 23,8g hỗn hợp muối gồm một muối cacbonat của kim loại hóa trị I và một muối cacbonat của kim loại hóa trị II vào dung dịch HCl dư thì thu được 0,4g khí. Đem cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan?
2) Hòa tan hoàn toàn 14,2g hỗn hợp Fe, CuO vào 100ml dd HCl thì thu được 1,68 lít khí A (đktc) và dd B
a) Tính khối lượng của mỗi chất trong hỗn hợp ban đầu
b) Tính CM của dd HCl
c) Tính CM của mỗi muối trong dd B (xem như V dd không thay đổi)
3) Cho 22g hỗn hợp Fe và Al tác dụng với dd HCl dư thu được 17,92 lít khí (đktc)
a) Tính thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu
b) Tính khối lượng dd HCl 7,3% tối thiểu cần dùng
c) Tính khối lượng hỗn hợp muối thu được khi cô cạn dd sau phản ứng

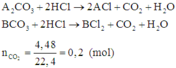
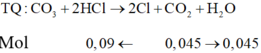
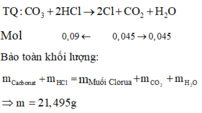
Bài 1 :
Khí là CO2 nCO2=4,4/44=0,1
Gọi muối kim loại hóa trị 1 là M2CO3
Gọi muối kim loại hóa trị 2 là NCO3
\(PTHH:M_2CO_3+2HCl\rightarrow2MCl+H_2O+CO_2\)
\(NCO_3+2HCl\rightarrow NCl_2+H_2O+CO_2\)
Ta có \(n_{CO3^{2-}}=n_{CO2}=0,1\)
\(\rightarrow m_{CO3^{2-}}=0,1.60=6\left(g\right)\)
\(\rightarrow m_M+m_N=23,8-6=17,8\)
Ta có nHCl=2nCO2=0,2=nCL
\(\rightarrow m_{muoi}=m_M+m_N+m_{Cl}=17,8+0,2.35,5=24,9\left(g\right)\)
Bài 3 :
a)
\(n_{H2}=\frac{17,92}{22,4}=0,8\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Gọi a là số mol Fe b là số mol Al
Giải hệ phương trình :
\(\left\{{}\begin{matrix}56a+27b=22\\a+\frac{1}{2}b=0,8\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\)
\(\%m_{Fe}=\frac{0,2.56}{22}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)
b)
\(n_{HCl}=0,2.2+0,4.3=1,6\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{1,6.36,5}{7,3\%}=800\left(g\right)\)
c)
\(m_{muoi}=m_{FeCl2}+m_{AlCl3}=0,2.127+0,4.133,5=78,8\left(g\right)\)