Hãy tính pH của dung dịch A gòm KCN 0,120M; NH3 0,150M và KOH 0,005M. Cho biết pKa của HCN là 9,35; của \(NH_4^+\) là 9,24
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Y gồm NO (4x mol) và H2 (x mol)
Bảo toàn N => nNH4+ = 0,19 - 4x
Bảo toàn electron: 2nZn = 3nNO + 2nH2 + 8nNH4+
=> nZn = 0,76 - 9x
=> nZnO = 0,57 - 6,75x
nH+ = 1,62 = 4.4x + 2x + 10(0,19 - 4x) + 2(0,57 - 6,75x)
=> x = 0,04
Muối gồm Zn2+ (0,7), NH4+ (0,03), Na+ (0,19) và Cl-(1,62)
=> m muối = 107,92

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
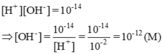
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

pH = 9,0 ≥ [H+] = 10-9 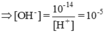
Cho phenolphtalein trong dung dịch này sẽ thấy phenolphtalein chuyển thành màu hồng (khi pH ≥ 8,3 phenolphtalein đổi màu)

Đáp án B
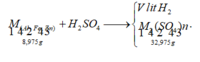
B T K L : n S O 4 2 - = m m u o i - m k l 96 = 32 , 975 - 8 , 975 96 = 0 , 25 ( m o l ) n H 2 = n S O 4 2 - = 0 , 25 m o l ⇒ V H 2 = 0 , 25 . 22 , 4 = 5 , 6 ( l í t )

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

[OH-]=1.10^-14/0.01=10^-12 (M) tính Ph=log[H+] từ kết quả của Ph xem nó lớn hơn 7 hay j xong suy ra môi trường ,môi trường axit thì quỳ đỏ môi trường kiềm quy xanh trung tính ko màu
NH4+ + OH- ----> NH3 + H2O
0,15 0,15
-0,005 0,15
TPGH ( A) : KCN 0,120 M ; NH3 0,15M và KOH 0,005 M
CN- + H2O <------> HCN + OH- Kb1= 10^-4,65 (1)
NH3 + H2O <-------> NH4+ + OH- Kb2= 10^-4,76 (2)
H2O <------> H+ + OH- Kw= 10^-14 (3)
Ta thấy K.C>> Kw , tính theo ĐKP áp dụng cho (1) và (2) :
[OH-]= C KOH + [ HCN] + [ NH4+]
Đặt [OH-] = x ---> x=5.10^-3 + Kb1. [CN-]/(x) + Kb2. [NH3]/(x)
Chấp Nhận [CN-]=C CN- = 0,12M ; [NH3]=C NH3 = 0,15 M
---- x= 5,9 x 10 ^-3 M---> kiểm tra đúng [CN-]=0,12 ; [NH3]= 0,15 M
---> pH= 11,77
Giúp mình 1 số thắc mắc về phần dung dịch và sự điện li | Cộng đồng học sinh Việt Nam - HOCMAI Forum
Link tham khảo