1) Hòa tan hoàn toàn 14,2g hỗn hợp Fe, CuO vào 100ml dd HCl thì thu duco975 1,68 lít khí A (đktc) và dd B.
a) Tính khối lượng của mỗi chất trong hỗn hợp ban đầu
b) Tính CM của dd HCl
c) Tính CM của mỗi muối trong dd B (xem như V dd không thay đổi)
2) Cho 22g hỗn hợp Fe và Al tác dụng với dd HCl dư thu được 17,92 lít (đktc)
a) Tính thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu
b) Tính khối lượng dd HCl 7,3% tối thiểu cần dùng
c) Tính khối lượng hỗn hợp muối thu được khi cô cạn dd sau phản ứng

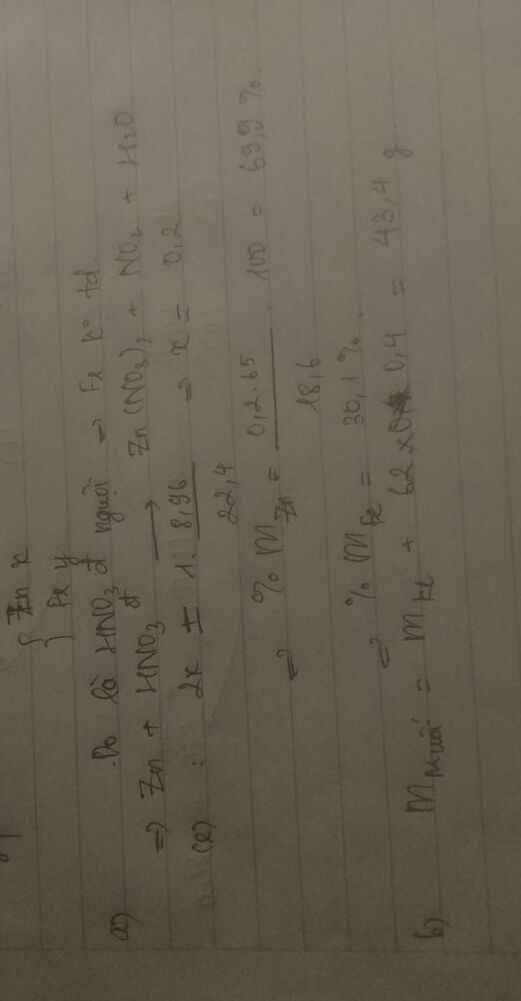

a, Chỉ Fe tạo khí
nH2= 1,68/22,4= 0,075 mol
Fe+ 2HCl -> FeCl2+ H2 (1)
=> nFe= nFeCl2= 0,075 mol; nHCl(1)= 0,15 mol
mFe= 0,075.56= 4,2g
=> mCuO= 14,2-4,2= 10g
b,
nCuO= 10/80= 0,125 mol
CuO+ 2HCl -> CuCl2+ H2O (2)
=> nCuCl2= 0,125 mol; nHCl(2)= 0,25 mol
Tổng mol HCl= nHCl(1)+ nHCl(2)= 0,4 mol
=> CM HCl= 0,4/0,1= 4M
c,
CM FeCl2= 0,075/0,1= 0,75M
CM CuCl2= 0,125/0,1= 1,25M
C2
a,
nH2= 17,92/22,4= 0,8 mol
Fe+ 2HCl -> FeCl2+ H2
2Al+ 6HCl -> 2AlCl3+ 3H2
Gọi x là mol Fe, y là mol Al
Ta có hệ: 56x+ 27y= 22 và x+ 1,5y= 0,8
<=> x= 0,2; y= 0,4
%Fe= 0,2.56.100220,2.56.10022= 50,9%
%Al= 49,1%
b,
nHCl= 2nH2= 1,6 mol
=> mHCl= 1,6.36,5= 58,4g
=> mdd HCl= 58,4.1007,358,4.1007,3= 800g
c,
mH2= 0,8.2= 1,6g
BTKL, m muối= 22+58,4-1,6= 78,8g
Bài 1 :
a)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(n_{H2}=\frac{1,68}{22,4}0,075\left(mol\right)\)
\(\rightarrow n_{Fe}=n_{H2}=0,075\left(mol\right)\)
\(m_{Fe}=0,075.56=4,2\left(g\right),m_{CuO}=14,2-4,2=10\left(g\right)\)
\(n_{CuO}=\frac{10}{80}=0,125\left(mol\right)\)
\(n_{HCl}=0,075.2+0,125.2=0,4\left(mol\right)\)
\(CM_{HCl}=\frac{0,4}{0,1}=4M\)
c)
\(CM_{FeCl2}=\frac{0,075}{0,1}=0,75M\)
\(CM_{CuCl2}=\frac{0,125}{0,1}=1,25M\)
Bài 2 :
a)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{H2}=\frac{17,92}{22,4}=0,8\left(mol\right)\)
Gọi a là nFe b là nAl
Giải hệ phương trình :
\(\left\{{}\begin{matrix}56a+27b=22\\a+\frac{1}{2}b=0,8\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\)
\(\%m_{Fe}=\frac{0,2.56}{22}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)
b)
\(n_{HCl}=0,8.2=1,6\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{1,6.36,5}{7,3\%}=800\left(g\right)\)
c)
\(m_{muoi}=0,2.127+0,4.133,5=78,8\left(g\right)\)